| Titel: | Neue Anleitung zur Chlorometrie; von Hrn. Gay-Lussac. |
| Fundstelle: | Band 60, Jahrgang 1836, Nr. XXVI., S. 128 |
| Download: | XML |
XXVI.
Neue Anleitung zur Chlorometrie; von Hrn.
Gay-Lussac.
Aus den Annales de Chimie et de Physique. November
1835, S. 225.
Mit Abbildungen auf Tab.
II.
Gay-Lussac's Anleitung zur Chlorometrie.
Das Verfahren, welches ich im Jahre 1824Polytechnisches Journal Bd. XIV. S.
422. zur Bestimmung des Chlorgehalts der verschiedenen bleichenden
Chlorverbindungen angab,
gruͤndete sich auf die Anwendung des Indigo's und liefert auch genaue und
uͤbereinstimmende Resultate, wenn es gehoͤrig ausgefuͤhrt wird;
der Indigo veraͤndert sich aber, worauf ich selbst aufmerksam machte, mit der
Zeit, wodurch jene Chlorprobe unsicher wird, und dieser Umstand kann sogar dem
Betrug zum Vorwand und zur Entschuldigung dienen. Da natuͤrlich ein
verlaͤßlicheres Verfahren fuͤr den Handel und die Industrie sehr
wuͤnschenswerth war, so veranlaßte mich dieß neue Untersuchungen anzustellen;
ich glaube meinen Zwek auch erreicht zu haben und uͤbergebe den neuen
Chlorometer, nachdem er sich mir waͤhrend mehr als dreijaͤhrigen
Gebrauchs bewaͤhrt hat, hiemit der Publicitaͤt. Bei dieser Gelegenheit
werde ich auch das Verfahren beschreiben, wie man den Werth der Manganoxyde,
hinsichtlich der Quantitaͤt Chlor die sie liefern koͤnnen, bestimmen
kann.
Das neue chlorometrische Verfahren beruht auf der Anwendung einer der drei folgenden
Substanzen: der arsenigen Saͤure, des Cyaneisenkaliums (eisenblausauren
Kalis), oder des salpetersauren Queksilberoxyduls. Diese drei Substanzen
koͤnnen mit beinahe gleichem Vortheil angewandt werden; die Apparate sind
dieselben und die Manipulationen wenig verschieden. Das Verfahren mit der arsenigen
Saͤure wird jedoch wegen der Scharfe der Resultate ohne Zweifel den beiden
anderen vorgezogen werden: deßwegen will ich es auch zuerst beschreiben.
Ich habe fuͤr den neuen Chlorometer dieselbe Basis, dieselbe Graduirung,
welche der alte haͤtte, beibehalten; ich nahm naͤmlich als Einheit der
Entfaͤrbungskraft des Chlors, die Entfaͤrbungskraft eines Volums
trokenen Chlorgases, welches bei 0° Temperatur und 0,760 Meter Druk gemessen
und in seinem gleichen Volum Wasser aufgeloͤst worden ist. Diese Einheit wird
in 100 gleiche Theile oder Grade abgetheilt. Ich haͤtte gerne eine andere
Graduirung angenommen, welche anstatt Volumen, Gewichte angezeigt haͤtte; sie
wuͤrde sich aber von der jezt allgemein eingefuͤhrten zu sehr entfernt
haben.
Wir sezen voraus, man habe sich eine Chloraufloͤsung bereitet, die ihr
gleiches Volum Chlorgas enthaͤlt und eine Aufloͤsung von arseniger
Saͤure von solcher Staͤrke, daß gleiche Volume der beiden
Aufloͤsungen sich gegenseitig vollstaͤndig zerstoͤren. Der
Deutlichkeit wegen werden wir sie in der Folge durch die Benennung normale Chloraufloͤsung und normale Arsenikaufloͤsung unterscheiden; und sogleich angeben, wie
wir die Staͤrke oder den Gehalt eines Chloruͤrs, z.B. des Chlorkalks
messen.
Man loͤst von dem zu pruͤfenden Chlorkalk 10 Gramm in so viel Wasser
auf, daß die Aufloͤsung mit sammt dem Saze genau das Volum eines Liters
einnimmt. Wenn man nun ein constantes Volum von dieser Aufloͤsung nimmt, z.B.
10 Kubikcentimeter, die in 100 gleiche Theile abgetheilt sind und allmaͤhlich
von der Aufloͤsung der arsenigen Saͤure, die in denselben Theilen
gemessen ist, so lange hinzugießt, bis das Chlor zerstoͤrt ist, so wird die
Staͤrke des Chloruͤrs der Anzahl der Maaßtheilchen
Arsenikaufloͤsung, welche es erforderte, proportional seyn. Zerstoͤrte
z.B. das Chloruͤr 100 Theile Arsenikaufloͤsung, so hat es den
Normalgehalt von 100°: zerstoͤrte es aber nur 80 Theile
Arsenikaufloͤsung, so hat es den Gehalt von 80° etc.
Diese Probe ist gewiß sehr einfach, weil der Gehalt des Chloruͤrs durch das
Volum der normalen Arsenikaufloͤsung, welche zerstoͤrt wurde,
unmittelbar angezeigt wird; sie ist aber nicht genau. Wenn man naͤmlich die
Arsenikaufloͤsung, welche sehr sauer ist, in den Chlorkalk gießt, so wird
lezterer ebenfalls bald sehr sauer; es entbindet sich eine Menge Chlor und das
Resultat wird dadurch sehr ungenau. Gießt man hingegen die
Chlorkalkaufloͤsung in die Arsenikaufloͤsung, so findet zwar dieser
Uebelstand nicht Statt, weil das Chlor immer arsenige Saͤure vorfindet,
worauf es wirken kann, sie moͤgen beide noch so verduͤnnt seyn; aber
der Gehalt des Chlorkalks ergibt sich dann nicht mehr direct; denn er steht im
umgekehrten Verhaͤltniß zu der Anzahl von Maaßtheilen Chloruͤr, welche
erforderlich waren, um das Maaß Arsenikaufloͤsung zu zerstoͤren. Waren
50 Theile Chloruͤr noͤthig, so wird der Gehalt desselben 100 ×
100/50 = 200° seyn; waren davon 200 noͤthig, so wird der Gehalt 100
× 100/200 = 50° etc. seyn. Diese Berechnung laͤßt sich aber
umgehen, wenn man eine Tabelle besizt, worin fuͤr jedes Volum
Chloruͤr, welches zur Zerstoͤrung des constanten Maaßes
Arsenikaufloͤsung erforderlich war, der entsprechende Gehalt angegeben ist.
Wir theilen diese Tabelle hier mit:
Textabbildung Bd. 60, S. 131
Angewandtes Chloruͤr.
Entsprechender Gehalt. Angewandtes Chloruͤr. Entsprechender Gehalt.
Angewandtes Chloruͤr. Entsprechender Gehalt. Angewandtes Chloruͤr.
Entsprechender Gehalt. Angewandtes Chloruͤr. Entsprechender Gehalt.
Wir haben diese Tabelle nicht unter 40° fortgefuͤhrt, weil dieser
Gehalt im Handel nicht vorkommt. Wenn man sehr schwachen Chlorkalk zu untersuchen
hat, so ist es besser, ein 10, 5 oder 2 Mal kleineres Maaß von
Arsenikaufloͤsung zu nehmen, uͤbrigens wie gewoͤhnlich zu
verfahren, aber den gefundenen Gehalt mit 10,5 oder 2 zu dividiren.
Dieses Verfahren ist es, welchem wir zur Bestimmung des Gehalts eines
Chloruͤrs den Vorzug geben; wir werden aber doch noch zeigen, wie sich auch
das umgekehrte Verfahren, wobei man den Gehalt des Chloruͤrs unmittelbar ohne
Berechnung erfahrt, ebenfalls ausfuͤhren und anwenden laͤßt.
Bereitung einer Normalfluͤssigkeit, welche ihr gleiches
Volum Chlor (bei 0° Temp. und 0,760 Meter Druk gemessen)
enthaͤlt.
Wir muͤssen uns zuerst mit der Bereitung dieser Fluͤssigkeit
beschaͤftigen, weil sie zum Justiren der Normalaufloͤsung von
arseniger Saͤure, Cyaneisenkalium oder salpetersaurem Queksilberoxydul
unentbehrlich ist. Am einfachsten duͤrfte die Methode seyn, ein gegebenes
Volum Chlorgas durch ein gleiches Volum Wasser, worin Kalkerde, Natron oder Kali
aufgeloͤst ist, absorbiren zu lassen. Wir wollen sie zuerst beschreiben und
dann noch ein anderes Verfahren mittheilen, welches nicht weniger genau ist.
Man fuͤllt eine luftdicht verschließbare Flasche A
(Tab. II.), die ungefaͤhr ein Viertelsliter faßt, mit trokenem Chlorgas und
bemerkt genau die Temperatur und den Barometerstand, um das Volum des Chlors durch
Berechnung auf 0° und 0,760 Met. Druk reduciren zu koͤnnen. Man
verschließt die Flasche mit ihrem Pfropf, faßt sie am Halse und taucht sie umgekehrt
in ein tiefes Gefaͤß B, welches eine
duͤnne Kalkmilch oder eine schwache Aufloͤsung von Aezkali oder
Aeznatron enthaͤlt. Dann zieht man den Pfropf ganz wenig heraus, damit die
alkalische Aufloͤsung in die Flasche dringen kann und verschließt sie
sogleich wieder. Nach einigen Stoͤßen, die man der Flasche ertheilt, ohne sie
aus dem Bade zu nehmen, entsteht darin in Folge der Absorption des Chlors ein
verduͤnnter Raum; man zieht neuerdings den Pfropf ein wenig heraus, um
alkalische Aufloͤsung eintreten zu lassen, verschließt hierauf die Flasche
wieder, schuͤttelt sie und wiederholt diese Reihe von Operationen so lange,
bis das Chlor vollstaͤndig absorbirt ist.
Es ist zu bemerken, daß eine Vermischung des Chlors mit atmosphaͤrischer Luft
den Gehalt seiner Aufloͤsung nicht vermindert, weil in die Flasche immer nur
ein Volum Fluͤssigkeit treten kann, welches dem des Chlors genau gleich
ist.
Die so erhaltene Chloraufloͤsung wuͤrde den verlangten Gehalt von
100° haben, wenn das Gas bei 0° Temperatur und 0,760 Met. Druk
gemessen worden waͤre; wenn aber diese Bedingung nicht erfuͤllt wurde
und das Thermometer die Temperatur t, das Barometer den
Druk p anzeigte, so wird ihr wirklicher Gehalt seyn
100° × p/0,760 M. × 267/(267 + t). Es sey p = 0,750 Met.
und t = 16° C., so wird dieser Gehalt
100° × 0,750 M./0,760 M. × 267/283 = 94°,1 werden.
Wenn man also mit dieser Chloraufloͤsung von 94°, 2 Gehalt eine
Aufloͤsung von arseniger Saͤure von 100° bereiten wollte, so
muͤßte leztere von solcher Staͤrke seyn, daß davon nur ein durch
94°, 2 ausgedruͤktes Volum noͤthig waͤre, um ein durch
100 ausgedruͤktes Volum der Chloraufloͤsung zu zerstoͤren.
Anstatt das Chlorgas auszutroknen, kann man es auch mit Feuchtigkeit
gesaͤttigt anwenden. In diesem Falle wird, wenn man die der Temperatur t entsprechende Elasticitaͤt des Wasserdampfes
mit l bezeichnet, der Gehalt der Chloraufloͤsung
gleich seyn
100° × (p – f)/0,760 M. × 267/(267 + t).
Das andere Verfahren zur Bereitung der normalen Chloraufloͤsung besteht darin,
ein Quantum Braunstein mit Salzsaͤure zu behandeln, welches ein Liter
Chlorgas, bei 0° und 0,760 Met. Druk gemessen, liefern kann. Von ganz reinem
Mangansuperoxyd waͤren hiezu 3,980 Gr. erforderlich; da aber kein solches in
der Natur vorkommt, so hilft man sich dadurch, daß man das Quantum Sauerstoff
bestimmt, welches der anzuwendende Braunstein uͤber die erste Oxydationsstufe
noch enthaͤlt; denn einem gegebenen Volum Sauerstoff, welches er uͤber
diese Glaͤnze enthaͤlt, entspricht genau ein doppeltes Volum
Chlor.
Um den Sauerstoff zu erhalten, welchen das Manganoxyd liefern kann, erhizt man es mit
sehr concentrirter Schwefelsaͤure; das
Sauerstoffgas wird frei, sobald die Saͤure zu kochen anfaͤngt und man
braucht es dann nur aufzusammeln und zu messen. Es bleibt allerdings ein wenig
Mangansuperoxyd in der Aufloͤsung zuruͤk; dasselbe betraͤgt
aber nicht ganz ein Procent und kann uͤberdieß sehr genau geschaͤzt
werden. Man verfahrt folgender Maßen:
Man bringt in eine kleine Retorte (die ungefaͤhr 100 Gramm Wasser faßt) 3
Gramm Braunstein und 25 Kubikcentimeter (beilaͤufig 46 Gramm) sehr
concentrirte Schwefelsaͤure. Mit der Retorte wird eine Roͤhre D von sehr engem Durchmesser verbunden, deren Ende so hoch in die
Gloke hinaufreichen muß, daß sie nach beendigter Operation uͤber dem Niveau
des Wassers bleibt. E ist die graduirte Gloke, worin man
das Sauerstoffgas aufsammelt und F ihre Wanne. Das
Wasser in der Wanne wird mit Aezkali versezt, um die Kohlensaͤure zu
absorbiren, welche der Braunstein ausgeben koͤnnte.
Ehe man den Versuch beginnt, laͤßt man die mit ihrer Roͤhre versehene
Retorte die Temperatur des Laboratoriums annehmen, welche man so wie den
Barometerstand notirt; dann bringt man das Ende der Roͤhre D unter die graduirte Gloke und faͤngt an die
Retorte zu erhizen und die Schwefelsaͤure in gelindes Kochen zu bringen; die
Daͤmpfe verdichten sich im vorderen Theil des Halses, welcher gegen C geneigt ist und fallen in die Retorte zuruͤk.
Der Rest des Halses erhizt sich nicht und der Korkpfropf wird durchaus nicht
beschaͤdigt. Um jedoch seine Verkohlung zu verhindern, laͤßt man die
Roͤhre ein wenig in den Hals der Retorte hineinreichen; diese Vorsicht ist
aber nicht noͤthig, wenn man die Operation behutsam leitet. Die Beendigung
der Operation erkennt man daran, daß sich kein Gas mehr entbindet und das
schwefelsaure Mangan in der Retorte eine gruͤnliche Farbe annimmt, auch etwas
durchsichtig wird. Man beseitigt nun den Ofen unter der Retorte, damit sie desto
schneller abkuͤhlt; endlich bringt man die Fluͤssigkeit in der Gloke
und in der Wanne auf gleiches Niveau und nimmt die Roͤhre weg. Man braucht
dann nur noch das in der Gloke enthaltene Gas zu messen und fuͤr die
Feuchtigkeit, die Temperatur und den Druk die gehoͤrigen Correctionen zu
machen; wenn aber zwischen dem Anfang und Ende des Versuchs zu viel Zeit verstrichen
waͤre, koͤnnte der Druk und die Temperatur in diesen beiden
Zeitpunkten allerdings so verschieden seyn, daß es noͤthig wird, die
Capacitaͤt der Retorte zu kennen; dieß ist aber nicht schwierig. Man braucht
bloß nach beendigter Operation die Menge Wasser zu messen, welche erforderlich ist,
um die Retorte bis zum Pfropf voll zu fuͤllen; diese entspricht dem
Luftvolum, wovon die Correction vorgenommen werden muß; das der Roͤhre muß
darin inbegriffen seyn; man darf aber annehmen, daß lezteres so klein ist, um
vernachlaͤssigt werden zu koͤnnen.
Wir haben gesagt, daß ein wenig Mangansuperoxyd in der Aufloͤsung bleibt; und
in der That faͤrbt der Ruͤkstand in der Retorte das Wasser, worin man
ihn aufloͤst, sehr merklich rosenroth. Um dieses Quantum Mangansuperoxyd zu
bestimmen, oder vielmehr das darin enthaltene uͤberschuͤssige
Sauerstoffvolum, sezt man eine Aufloͤsung von arseniger Saͤure zu, die
genau ihr gleiches Volum Chlor oder ihr halbes Volum Sauerstoff zerstoͤren
kann. Bei einem solchen Versuche gaben uns 3 Gramm Braunstein 341,5 Kubikcentimeter
trokenes
Sauerstoffgas (bei 0° und 0,760 M. Druk gemessen) und es waren 6,4
Kubikcentimeter von der normalen Arsenikaufloͤsung noͤthig, um die
rosenrothe Aufloͤsung von schwefelsaurem Mangan zu zerstoͤren. Diese
6,4 Kubikcentimeter repraͤsentiren ein gleiches Volum Chlor, oder die
Haͤlfte dieses Volums, also 3,2 Kubikcentimeter Sauerstoff, folglich gaben
unsere 3 Gramm Mangansuperoxyd im Ganzen 341,5 Kubikcentimeter plus 3,2 Kubikcentimeter – 344,7 Sauerstoff.
Um nun zu erfahren, wie viel von diesem Braunstein erforderlich ist, um 500
Kubikcentimeter oder ein halbes kiter Sauerstoffgas, also ein Liter Chlor zu geben,
sezt man die Proportion an:
344,7 : 3 Oxyd = 500 : x = 4,352
Gr.,
d.h. wenn man 4,352 Gr. von diesem Braunstein mit
Salzsaͤure behandelt; so wird man genau ein Liter Chlor erhalten.
Waͤre das Mangansuperoxyd ganz rein gewesen, so haͤtten 3,980 Gr.
hingereicht; die Differenz entspricht dem Gehalt desselben an fremdartigen
Koͤrpern, naͤmlich Wasser, Eisen etc.
Bereitung der Normalaufloͤsung von arseniger
Saͤure. – Man macht diese Aufloͤsung mir
Salzsaͤure, die mit ihrem halben Volum Wasser verduͤnnt wurde. Die
arsenige Saͤure muß im Zustande eines feinen Pulvers und die
Salzsaͤure frei von schwefliger Saͤure seyn; denn da sich leztere mit
der Zeit in Schwefelsaͤure verwandelt, so wuͤrde sich die Starke der
Arsenikaufloͤsung andern. Man saͤttigt die Salzsaͤure kochend
mit arseniger Saͤure und nach dem Erkalten braucht man dann die
Aufloͤsung nur noch auf ihre Staͤrke zu probiren und so weit zu
verduͤnnen, daß sie ihr gleiches Volum normaler Chloraufloͤsung
zerstoͤrt. Der weiße Arsenik muß durchaus in einer Saͤure
aufgeloͤst seyn, und selbst nach seiner Vermischung mit der zu
pruͤfenden Chloruͤraufloͤsung noch einen Ueberschuß davon
enthalten; denn sonst wuͤrde die Reaction zwischen der arsenigen
Saͤure und dem Chloruͤr unvollstaͤndig bleiben. Die Reaction
erfolgt in diesem Falle augenbliklich; die arsenige Saͤure scheint sogar
vorzugsweise vor dem Indigo angegriffen zu werden. Denn wenn man ihre
Aufloͤsung mit schwefelsaurer Indigaufloͤsung schwach blau
faͤrbt und allmaͤhlich das Chloruͤr hineingießt, so wird sich
die blaue Farbe sehr lange halten und nur an den Stellen, wo das Chloruͤr
hineinfaͤllt, durch den Chloruͤberschuß, welcher nach der Verwandlung
der arsenigen Saͤure in Arseniksaure uͤbrig bleibt, nach und nach
zerstoͤrt werden.
Diese Bestaͤndigkeit des Indigoblau in der Arsenikaufloͤsung liefert
uns ein eben so einfaches als sicheres Mittel, die Fortschritte der Operation und
den Augenblik, wo sie ihre Graͤnze erreicht hat, zu erkennen; denn sobald die
arsenige Saͤure gaͤnzlich zerstoͤrt ist, verschwindet die blaue Farbe
durch den geringsten Ueberschuß von Chloruͤr augenbliklich und die
Fluͤssigkeit wird durchsichtig und klar wie Wasser.
Es handelt sich nun bloß noch darum, die Starke der Arsenikaufloͤsung
auszumitteln; ehe wir uns jedoch damit beschaͤftigen, muͤssen wir die
hiezu erforderlichen Instrumente und Manipulationen (eigentlich unseren neuen
Chlorometer) beschreiben.
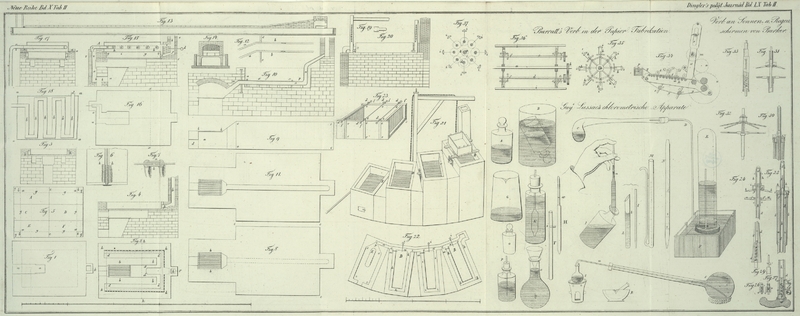
G (auf Tab. II.) ist das
zur Vermischung der Arseniksolution mit der Chlorkalkaufloͤsung bestimmte
Becherglas. Es muß einen flachen Boden und beilaͤufig 7 Centimeter
Durchmesser auf 12 Hoͤhe haben.
H ist die Saugroͤhre, welche bis zum Strich a
ein Volum Wasser, gleich 10 Kubikcentimeter oder 10 Gramm
faßt. Den Strich muß man, nachdem das Auge in gleiches Niveau mit der
Fluͤssigkeit gebracht ist, da die Fluͤssigkeitsoberflaͤche
allemal gekruͤmmt erscheint, genau horizontal als Tangente des Bogens
fuͤhren. Man fuͤllt die Saugroͤhre durch Aufsaugen oder
Eintauchen. Beim Aufsaugen laͤßt man die Fluͤssigkeit etwas
uͤber den Strich a steigen und legt in dem
Augenblik, wo der Mund die obere Oeffnung der Roͤhre verlaͤßt, schnell
den Zeigefinger der einen Hand darauf, waͤhrend man mit der anderen die
Flasche I haͤlt, aus welcher die
Fluͤssigkeit aufgesogen wurde; die untere Oeffnung der Saugroͤhre aber
stuͤzt man gegen den Hals der Flasche. Dann laͤßt man mittelst eines
geeigneten Druks des Zeigefingers auf die obere Oeffnung der Saugroͤhre und
einer leichten schwingenden Bewegung dieser Roͤhre zwischen den Fingern, die
Fluͤssigkeit langsam bis zum Striche a
herabsinken, was leicht zu bewerkstelligen ist, wenn der aufgesezte Zeigefinger
weder zu feucht noch zu troken war. Ist dieser Punkt erreicht, so druͤkt man
den Zeigefinger so fest auf, daß kein weiteres Sinken Statt finden kann und hebt nun
die Saugrohre bis uͤber das Becherglas G, in
welches man die Fluͤssigkeit entleert. Nachdem sie ganz ausgelaufen ist, kann
man in die Saugroͤhre blasen, um die lezten Antheile von Fluͤssigkeit
aus ihrem Schnabel auszutreiben. Die Messung ist alsdann beendigt.
Dieses Verfahren ist das bequemste und einfachste fuͤr diejenigen, welche in
chemischen Manipulationen geuͤbt sind; denjenigen, welche es nicht sind und
die daher beim Aufsaugen leicht etwas von der Arseniksolution in den Mund bekommen
koͤnnten, was nicht immer ganz gefahrlos seyn duͤrfte, rathen wir die
Saugroͤhre durch Eintauchen zu fuͤllen. Zu diesem Ende bringt man die
Fluͤssigkeit in eine Flasche K mit weiter
Oeffnung, die so tief ist, daß die Saugroͤhre sich darin von selbst ganz
anfuͤllt. Ehe man sie herauszieht, legt man den Zeigefinger auf die obere
Oeffnung und beendigt dann die Messung auf die angegebene Weise. Die Flasche muß man
mit einem Korkpfropf genau verschließen, um die Verdunstung der Fluͤssigkeit
zu verhindern; es ist sogar bequem, wenn das Ende der Saugroͤhre durch den
Pfropf geht und darin festhaͤlt.
Statt der Saugroͤhre kann man auch eine kleine, oben schief abgeschnittene,
unten geschlossene Glasroͤhre L nehmen, welche
bis zum Kreisstrich b 10 Kubikcentimeter faßt; um die
Messung zu beendigen, bedient man sich des Saugroͤhrchens I, womit man von der Fluͤssigkeit aus der
Roͤhre nehmen oder ihr das Fehlende zusezen kann, damit die
Oberflaͤche der Fluͤssigkeit den Strich b
beruͤhrt, wenn das Auge mit lezterem genau in gleichem Niveau ist. Man
entleert dieses Maaß, indem man es so neigt, daß der obere Rand der Oeffnung nach
Unten kommt, und wenn die Fluͤssigkeit ausgelaufen ist, ertheilt man der
Roͤhre einige Stoͤße, um die lezten Tropfen davon zu trennen.
M ist das zum Messen der zu pruͤfenden
Chlorkalkaufloͤsung bestimmte Meßkaͤnnchen: 100 Abtheilungen desselben
sind gleich 10 Kubikcentimeter, also dem so eben beschriebenen Maaß H oder L. Es muß
beilaͤufig denselben Durchmesser wie dieses Maaß haben und mit 180 bis 200
Abtheilungen versehen seyn.Anstatt das Meßkaͤnnchen in gleiche Theile einzutheilen, und so, daß
es das Volum der Chloruͤraufloͤsung ausdruͤkt,
koͤnnte man es auch unmittelbar nach der oben gegebenen Tabelle
graduiren, wodurch man sich die jedesmalige Einsicht derselben ersparte. Die Striche, welche die Abtheilungen bilden, kaͤmen einander zu nahe,
wenn man sie alle verzeichnen wuͤrde; man bringt daher nur einen um den
anderen wirklich an, so daß jede Abtheilung zwei Hunderttheile gilt; man kann aber
davon auch mit unbewaffnetem Auge leicht die Haͤlfte nehmen. Da ein Tropfen
das kleinste Quantum Fluͤssigkeit ist, welches man aus dem
Meßkaͤnnchen gießen kann, so muß man wissen, wie viele Tropfen eine
Abtheilung desselben ausmachen; man zaͤhlt daher die Tropfen, welche
noͤthig sind, um eine bestimmte Anzahl Abtheilungen zu fuͤllen. Wenn
man z.B. von 0° bis 10° fuͤnfzehn Tropfen erhielt, entspricht
jeder Tropfen 10/15 oder 2/3 Grad. Damit die Tropfen huͤbsch rund aus der
Meßkanne kommen und nicht an der Schnauze herablaufen, muß man den Rand der
Ausgußoͤffnung leicht mit Wachs uͤberziehen; zu diesem Ende erhizt man
dieselbe so stark, daß sie das Wachs zum Schmelzen bringt, wenn man sie darauf
reibt.
N ist eine Saugroͤhre fuͤr die
Arsenikaufloͤsung, an welcher die Striche fuͤr 1, 2 und 5
Kubikcentimeter angegeben sind.
O ist eine Flasche mit eingeriebenem Stoͤpsel,
welche 90 bis 100 Gramm
Wasser faßt. Sie dient wie das Becherglas G zur
Vermischung des Chloruͤrs mit der Arsenikaufloͤsung.
P ist eine Flasche, welche schwefelsaure
Indigaufloͤsung von solcher Starke enthaͤlt, daß ein Tropfen der
normalen Chloruͤraufloͤsung 6 bis 8 Tropfen derselben
entfaͤrbt. Sie ist mit einem Korke verschlossen, durch welchen ein
Glasroͤhrchen von 3 bis 4 Millimeter innerem Durchmesser in die
Fluͤssigkeit reicht. Wenn man die Arsenikaufloͤsung blau
faͤrben will, nimmt man die Roͤhre heraus und macht durch eine
schwache Erschuͤtterung den Tropfen Indigaufloͤsung, welcher ihr
anhing, los.
Q ist ein Ballon, welcher bis zum Strich c genau ein Liter faßt: er dient zum Messen der
Chloruͤraufloͤsung, deren Volum immer ein Liter seyn muß.
Dieses sind nun die zur Chlorometrie erforderlichen Instrumente;Den vollstaͤndigen Chlorometer nebst der Probefluͤssigkeit
erhaͤlt man bei Hrn. Collardeau in Paris
(rue du Faubourg-Saint-Martin,
No. 56). wir koͤnnen jezt das Verfahren beschreiben, wie man sich eine
Arsenikaufloͤsung von solcher Staͤrke verschafft, daß sie genau ihr
gleiches Volum normaler Chloruͤraufloͤsung zerstoͤrt.
Da die Arsenikauflosung sehr stark ist, so nimmt man davon als erste
Annaͤherung mit der Saugroͤhre N 2
Kubikcentimeter oder 1/5 des Maaßes H, gießt sie in das
Becherglas G und faͤrbt sie schwach mit einem
Tropfen Indigaufloͤsung. Andererseits fuͤllt man das
Meßkaͤnnchen M bis zur Abtheilung 0° mit
normaler Chloraufloͤsung, und gießt, indem man das Becherglas mit der einen
Hand haͤlt und ihm eine drehende Bewegung ertheilt, mit der anderen die in
dem Meßkaͤnnchen enthaltene Chloraufloͤsung hinein. Sobald die blaue
Farbe aufhoͤrt, sehr merklich zu seyn, sezt man noch einen Tropfen
Indigaufloͤsung zu und faͤhrt fort Chloraufloͤsung zuzusezen,
bis die blaue Faͤrbung ploͤzlich verschwindet. Die Probe ist alsdann
beendigt. Wenn man von der Chloraufloͤsung 92 Abtheilungen des
Meßkaͤnnchens gebraucht hat, wird ihre Staͤrke durch 10/092 =
108°,7 ausgedruͤkt; da man aber nur 1/5 des Volums der arsenigen
Saͤure angewendet hat, so muß die wahre Staͤrke 5 Mal so groß, also
gleich 543°,5 seyn.
Waͤre diese erste Bestimmung genau, so duͤrfte man nur die
Arsenikaufloͤsung mit ihrem 4,435 fachen Volum Wasser verduͤnnen, um
sie auf den Gehalt oder die Starke von 100° zu bringen. Angenommen man
haͤtte etwas weniger Wasser zugesezt und es seyen nun 98 Abtheilungen
Kalkchloruͤr erforderlich, um das ganze Maaß Arsenikaufloͤsung zu
zerstoͤren, so wird ihre Staͤrke 100/98 = 102°, also um 2° zu hoch seyn.
Um sie auf 100° zuruͤkzubringen, vergroͤßert man ihr Volum im
Verhaͤltniß von 100 zu 102; d.h. man versezt sie mit 2/100 Wasser.
Betraͤgt das Volum der Arsenikaufloͤsung 2,430 Liter, so machen die
2/100 dieses Volums 0,0486 Liter oder 48,6 Gramm Wasser aus. Die Staͤrke der
Arsenikaufloͤsung ist nun bestimmt; man thut aber sehr gut, den Versuch zu
wiederholen.Wenn man sich auf die Reinheit der arsenigen Saͤure verlassen
koͤnnte, so ließe sich die Normalaufloͤsung derselben
unmittelbar auf die Art darstellen, daß man 4,439 Gramm arseniger
Saͤure in Salzsaͤure aufloͤst und dann die
Aufloͤsung bis auf das Volum eines Liters verduͤnnt. Ich habe
diese Methode sehr oft angewandt, und die Resultate mit der
kaͤuflichen arsenigen Saͤure wichen bisweilen um kein ganzes
Procent von denjenigen ab, welche ich mit solcher erhielt, die zuvor durch
Aufloͤsung gereinigt und dann gut ausgetroknet worden war.A. d. O.
Pruͤfung des Chlorkalks.
Nachdem man sich die Normalaufloͤsung von arseniger Saͤure bereitet
hat, bietet die Pruͤfung des Chloruͤrs gar keine Schwierigkeit mehr
dar. Man waͤhlt naͤmlich aus allen Theilen der Masse des zu
pruͤfenden Chlorkalks Proben, und aus diesen eine Probe von 10 Gramm, reibt
diese in einem Porzellan- oder Glasmoͤrser R mit etwas Wasser an, gießt dann mehr Wasser zu, laͤßt absezen,
decantirt die Fluͤssigkeit in den Ballon Q von 1
Liter Capacitaͤt, reibt den Ruͤkstand nochmals mit Wasser ab,
decantirt wieder, und verfaͤhrt so noch einige Male, worauf das
Chloruͤr erschoͤpft ist; dann gießt man der Fluͤssigkeit so
viel Wasser zu, daß sie 1 Liter betraͤgt und schuͤttelt wohl um.
Mit dieser Aufloͤsung fuͤllt man nun das Meßkaͤnnchen bis zur
ersten Abtheilung O. Andererseits bringt man in das
Becherglas G ein Maaß H
schwach mit Indigo gefaͤrbter Arsenikaufloͤsung; dann gießt man wie
vorher, indem man das Becherglas mit der einen Hand haͤlt und es
bestaͤndig sanft hin- und herbewegt, nach und nach Chloruͤr aus
dem Meßkaͤnnchen, welches man in der anderen Hand hat, hinein. Wenn die blaue
Farbe kaum mehr merklich ist, erhoͤht man sie wieder durch einen Tropfen
Indigaufloͤsung. Von diesem Augenblik an muß man aber sehr behutsam seyn; man
darf von dem Chloruͤr nur langsam und tropfenweise noch zusezen, denn nach
beendigter Probe entfaͤrbt sich die Arsenikaufloͤsung
ploͤzlich. Angenommen, man habe 108 Abtheilungen Chloruͤr gebraucht,
um das Maaß Arsenikaufloͤsung zu zerstoͤren, so wird die
Staͤrke dieses Chloruͤrs nach der Tabelle 92°,6 seyn.
Dieses Resultat kann als hinreichend genau betrachtet werden, weil man nur 2 Tropfen
Indigaufloͤsung zusezte, welche ungefaͤhr 1/3 Grad entsprechen; wenn aber
eine groͤßere Genauigkeit erforderlich seyn sollte, so macht man die Probe
neuerdings, ohne die Arsenikaufloͤsung zu faͤrben; man gießt 106 bis
107 Abtheilungen Chlor, kalk hinein und sezt erst dann einen Tropfen
Indigaufloͤsung zu, welcher zur Beendigung der Operation hinreicht.
Wir wollen annehmen, man habe wieder 108 Abtheilungen Chlorkalk gebraucht, um das
Maaß Arsenikaufloͤsung zu zerstoͤren. Der zulezt zugesezte Tropfen war
noͤthig, aber nur zum Theil, denn ein anderer Tropfen haͤtte keine
Wirkung hervorgebracht; man darf ihn also in zwei gleiche Theile abtheilen, wovon
man annehmen kann, daß der eine angewandt wurde, der andere aber nicht. Da nun ein
Tropfen des Meßkaͤnnchens 2/3 einer Abtheilung desselben entspricht, so muß
man die Haͤlfte davon, oder 1/3 von 108 abziehen, wodurch diese Zahl auf 107
2/3, und der Gehalt von 92°,6 auf 92°,8 reducirt wird.
Andererseits koͤnnen 2 Tropfen Indigo wohl ungefaͤhr 1/3 Tropfen
Chloruͤr erfordern (etwas mehr oder weniger), der also in Ueberschuß zugesezt
worden ist. Da man nun einerseits einen halben Tropfen Chloruͤr, welcher
nicht benuzt wurde, abziehen und andererseits von der zweiten Haͤlfte
annehmen muß, daß sie zur Entfaͤrbung des Indigo's diente, so darf man den
lezten Tropfen Chloruͤr, welcher die Entfaͤrbung hervorbrachte, nicht
rechnen. Das angewandte Chloruͤr waͤre in diesem Falle gleich 107 1/3
Abtheilungen und seine Staͤrke 93°,1.
Der Fehler, welcher dadurch begangen wird, daß man einen Tropfen Chloruͤr zu
viel zusezt, ließe sich durch Anwendung groͤßerer Maaße vermindern;
fuͤr den gewoͤhnlichen Zwek ist dieß aber ganz
uͤberfluͤssig, weil der Werth des Chlorkalks nicht so groß ist, daß
man die Genauigkeit so weit treiben muß. Wenn man endlich die
Normalaufloͤsung der arsenigen Saͤure danach richtet, kann man den
lezten Tropfen der normalen Chloraufloͤsung rechnen oder nicht, vorausgesezt,
daß man bei den Proben der Chloruͤre genau auf dieselbe Art zaͤhlt. So
erhaͤlt man auf einfachere Weise ein eben so genaues Resultat, und wir nehmen
im Folgenden immer an, daß der lezte Tropfen Chloruͤr, welcher die
Entfaͤrbung bewirkte, zum Volum des angewandten Chloruͤrs
gehoͤrt.
Einige Anwendungen.
Man erinnere sich, daß man zur Ausmittelung der Staͤrke des Chlorkalks von
demselben 10 Gramm nimmt, also den hundertsten Theil eines Kilogramms. Wenn man also
die Staͤrke oder den Gehalt eines Chlorkalks z.B. zu 95° gefunden hat,
so wird ein Kilogramm desselben 9500° enthalten.
Es ist ein Chlorkalk von 95° gegeben und man will wissen, wie viele Kilogramme davon noͤthig sind, um
150 Liter einer Aufloͤsung von 15° zu erhalten.
Die Aufloͤsung muß 15° × 150 = 2250° enthalten. Das
erforderliche Quantum Chlorkalk ergibt sich in Kilogrammen aus der Proportion:
9500° : 1 Kil. = 2250° : x = 2250/9500 = 0,237 Kil.
Man braucht folglich nur 237 Gramm von diesem Chlorkalk aufzuloͤsen.
Es sind 150 Liter Chlorkalkaufloͤsung von
15° gegeben und sie sollen auf 40° gebracht werden.
Man hat in der Aufloͤsung
15° × 150 Liter
=
2250°;
man will, daß sie enthalte
40° × 150
=
6000°;
was man zusezen muß, ist also
die Differenz
dieser zwei Zahlen, oder
3750°.
Wenn nun der anzuwendende Chlorkalk 95° stark ist, sezt man die Proportion
an:
9500° : 1 Kil. = 3750° : x Kil. = 0,395 Kil.
Wenn 150 Liter
Chlorkalkaufloͤsung von 235° gegeben
sind, wie viel Wasser muß man zusezen, um sie auf 80° zuruͤkzubringen?
Wenn man das ganze Volum der Aufloͤsung nach dem Zusaze des Wassers mit x bezeichnet, wird die Anzahl von Graden, oder
80° × x, gleich seyn der gegebenen Anzahl
von Graden, oder 80° × x = 235°
× 150 Lit.; daraus ergibt sich x = 440,6 Lit. Man
braucht also an Wasser nur die Differenz zwischen 440,6 und 150 Lit.,
naͤmlich 290,6 Lit. zuzusezen.
Es sey der Gehalt einer sehr schwachen
Chlorkalkaufloͤsung zu bestimmen.
Anstatt ein ganzes Maaß Arsenikaufloͤsung zu nehmen, nimmt man davon nur 1/10
oder 1 Kubikcentimeter mit der Saugroͤhre N. Man
ermittelt den Gehalt wie gewoͤhnlich und dividirt das Resultat mit 10. Wenn
man z.B. fand, daß 200 Abtheilungen Chloruͤr erforderlich sind, um 1/10
normaler Arsenikaufloͤsung zu zerstoͤren, so ist der Gehalt nach der
Tabelle 50° und reducirt sich, mit 10 dividirt, auf 5°.
Es sey der Gehalt einer sehr starken
Chlorkalkaufloͤsung zu bestimmen.
Man kann denselben direct ausmitteln: wenn man z.B. findet, daß nur 20 Abtheilungen
Chloruͤr noͤthig sind, betraͤgt der Gehalt 500°; um aber
ein genaueres Resultat zu erhalten, nimmt man 5 Maaß Arsenikaufloͤsung; man findet dann
vielleicht den Gehalt gleich 99°, was mit 5 multiplicirt, 495° gibt.
Das leztere Resultat verdient in diesem Falle mehr Zutrauen, als das zuerst
erhaltene.
Wie man die Chlorometergrade in Volum- und
Gewichtstheile von Chlor umsezen kann.
Nach der angenommenen Graduirung entspricht 1 Grad dem hundertsten Theile eines
Liters; folglich entsprechen 95° z.B. fuͤr 10 Gramm Chlorkalk 0,95
Liter. Fuͤr 100 Gramm macht dieß 9,5 Lit. und fuͤr 1 Kil. 95 Lit. Die
Anzahl von Graden, welche der Gehalt angibt, entspricht also fuͤr 1 Kil.
Chlorkalk einer gleichen Anzahl von Litern troknen Chlorgases, bei 0°
Waͤrme und 0,760 Met. Druk gemessen.
Ein Liter Chlorgas wiegt unter diesen Umstaͤnden 3,1689 Gr. Fuͤr 1 Kil.
Chlorkalk wiederholt sich also dieses Gewicht so oft, als der Gehalt Grade angibt.
Wenn z. V. der Gehalt des Chloruͤrs 108° ist, wird 1 Kil.
desselben
3,1689 Gr. × 108 = 342,2 Gr. Chlor enthalten.
Bestimmung der Staͤrke des Chlorkalks, indem man die
Arsenikaufloͤsung in das Chloruͤr gießt.
Wir haben bereits bemerkt, welchen Vortheil dieses Verfahren einerseits und welchen
Nachtheil es andererseits hat; der Vortheil besteht darin, daß man unmittelbar die
Staͤrke des Chloruͤrs durch das angewandte Volum
Arsenikaufloͤsung erfahrt; der Nachtheil aber darin, daß der Chlorkalk durch
die Arsenikaufloͤsung angesaͤuert wird und daher eine
betraͤchtliche Menge Chlor verloren geht: dazu kommt noch, daß sich das Ende
der Reaction nicht so leicht erkennen laͤßt, wie bei der umgekehrten
Verfahrungsweise. Man kann jedoch diese nachtheiligen Umstaͤnde vermeiden,
wenn man folgender Maßen verfaͤhrt:
Man bringt die 10 Kubikcentimeter Chlorkalkaufloͤsung in die kleine Flasche
mit eingeriebenem Stoͤpsel O, fuͤllt die
Meßkanne M mit der Aufloͤsung der arsenigen
Saͤure und gießt von lezterer nach und nach hinzu, indem man die Flasche nur
schwach umschuͤttelt. Von Zeit zu Zeit schließt man sie mit ihrem
Stoͤpsel, den man das erste Mal befeuchtet, wenn er es nicht seyn sollte, und
ertheilt ihr einige Stoͤße.
Um das Ende der Reaction zu erkennen, sezt man von Zeit zu Zeit einen Tropfen
Indigaufloͤsung zu; so lange diese entfaͤrbt wird, ist noch freies
Chlor vorhanden; der erste Tropfen aber, der nicht voͤllig entfaͤrbt
wird, zeigt das Ende der Operation an. Da aber durch den haͤufigen Zusaz von
Indig das Resultat veraͤndert wird (indem dadurch Chlor consumirt wird), so
muß man einen zweiten Versuch anstellen, bei dem man sich dem gefundenen Resultate so viel als
moͤglich naͤhert und dann erst mit der Indigaufloͤsung
pruͤft. Oder man koͤnnte auch eine mit Indigaufloͤsung
gefaͤrbte Aufloͤsung von arseniger Saͤure anwenden, deren
Starke aber dann im gefaͤrbten Zustande bestimmt seyn muͤßte. Der
erste uͤberfluͤssige Tropfen arseniger Saͤure wuͤrde
dann an dem Orte, wo er in die Fluͤssigkeit fiele, gefaͤrbt bleiben.
Hierauf muß man achten; denn beim Umschuͤtteln wird die Farbe sich zu sehr
schwaͤchen, als daß sie bemerklich bleiben koͤnnte. Man koͤnnte
zwar die Arsenikaufloͤsung so stark faͤrben, daß ein einziger Tropfen
davon die ganze Fluͤssigkeit hinreichend faͤrben wuͤrde; dann
muͤßte man aber befuͤrchten, daß sich der Indig mit der Zeit
veraͤndert und so das Resultat ungenau wuͤrde. Wenn man diese Methode
richtig anwendet, erhaͤlt man ganz dieselben Resultate wie bei der
ersten.
Anwendung des Cyaneisenkaliums (Blutlaugensalzes) als
chlorometrisches Reagens, anstatt arseniger Saͤure.
Die Instrumente und Manipulationen sind ganz dieselben wie fuͤr die arsenige
Saͤure; wenige Worte reichen daher hin, um das chlorometrische Verfahren mit
Cyaneisenkalium einleuchtend zu machen.
Man bereitet sich zuerst eine Aufloͤsung von Blutlaugensalz in Wasser, die ihr
gleiches Volum normaler Chloraufloͤsung zerstoͤrt. Von dem
kaͤuflichen Blutlaugensalze braucht man beilaͤufig 35 Gr. zu einem
Liter Aufloͤsung.
Diese Aufloͤsung von Blutlaugensalz wirkt gar nicht oder wenigstens nur sehr
schwach auf eine Chlorkalkaufloͤsung; ist sie aber angesaͤuert, so
nimmt sie im Augenblik des Zusammenmischens eine schoͤne gelbe Farbe an,
welche sie waͤhrend der ganzen Operation, selbst nach der Saͤttigung
beibehaͤlt. Um den Saͤttigungspunkt zu entdeken, bedient man sich
ebenfalls der Indigaufloͤsung; ein Tropfen derselben, der
Salzaufloͤsung zugesezt, erzeugt durch die Mischung von Gelb und Blau
augenbliklich eine schoͤne gruͤne Faͤrbung, welche immer
schwaͤcher wird und immer mehr in Gelb uͤbergeht, je naͤher man
der Saͤttigung kommt; sezt man nun noch einen Tropfen zu, so wird die Farbe
wieder lebhaft gruͤn, aber in dem Moment der erreichten Saͤttigung
(sobald alles Blutlaugensalz zerstoͤrt ist) ploͤzlich gelb. Nur ist
bei diesem Verfahren der Saͤttigungspunkt nicht leicht so genau zu treffen,
wie mit Arsenikaufloͤsung. Es ist uͤbrigens dieselbe Tabelle wie bei
der arsenigen Saͤure brauchbar und auch in Bezug darauf, ob man die
Chlorkalkaufloͤsung zum Blutlaugensalz sezt oder umgekehrt verfahrt, gilt
ganz dasselbe.
Anwendung des salpetersauren Queksilberoxyduls als
chlorometrisches Reagens.
Das salpetersaure Queksilberoxydul gibt bei Vermischung mit einer
Kochsalzaufloͤsung oder mit Salzsaͤure einen weißen Niederschlag von
Queksilberchloruͤr (Calomel), welcher auf Zusaz einer Chlor- oder
Chlorkalkaufloͤsung in wenigen Augenbliken vollstaͤndig verschwindet,
indem er sich, wenn naͤmlich noch freie Saͤure vorhanden ist, in
aufloͤsliches Chlorid (Sublimat) verwandelt. Man hat also die Auflosung des
salpetersauren Queksilbers nur kurz vor der Probe mit ein wenig Salzsaͤure zu
versezen, damit nicht nur die Basis des Chlorkalks gesaͤttigt, sondern auch
das Queksilber desto leichter als Chloruͤr gefaͤllt werden kann.Da das salpetersaure Queksilber gewoͤhnlich hinreichend sauer ist, um
das Alkali des Chloruͤrs zu saͤttigen, so ist es besser, ihm
bloß Kochsalz zuzusezen; denn bei Zusaz von zu viel Salzsaͤure
wuͤrde sich Koͤnigswasser bilden und dadurch das Resultat
veraͤndert werden.A. d. O.
Die Instrumente und Manipulationen sind durchaus dieselben wie fuͤr die
arsenige Saͤure und das Cyaneisenkalium. Nur bietet das salpetersaure
Queksilberoxydul den Vortheil dar, daß keine Indigaufloͤsung noͤthig
ist, um den Saͤttigungspunkt zu erkennen. Dieser tritt naͤmlich mit
dem Moment ein, wo der Niederschlag von Queksilberchloruͤr
vollstaͤndig verschwindet oder auf Zusaz eines einzigen Tropfens Chlorkalk
verschwinden kann. Ich rathe in allen Faͤllen sich zur Probe der Flasche O anstatt des Becherglases G
zu bedienen und sie, nachdem der Stoͤpsel eingesezt wurde, von Zeit zu Zeit
stark umzuschuͤtteln; dadurch wird ein wenig Chlor zuruͤkgehalten,
welches, wenn man den Versuch im Becherglase G
anstellte, entweichen wuͤrde. Ich fand bisweilen einen Unterschied von
fuͤnf Grad in der Starke des Chlorkalks, indem ich das eine oder andere
Verfahren anwandte.
Wenn man sich der Flasche mit eingeriebenem Stoͤpsel bedient, so ist es
uͤbrigens gleichguͤltig, ob man das Chloruͤr in das
salpetersaure Queksilber gießt, oder umgekehrt verfaͤhrt; die Resultate sind
in beiden Faͤllen dieselben; wuͤrde man aber ein Gefaͤß mit
weiter Oeffnung anwenden, so ginge Chlor verloren und die Staͤrke des
Chloruͤrs koͤnnte um mehr als 1/10 ungenau gefunden werden.
Das salpetersaure Queksilber wurde schon im December 1829 von Hrn. Balland als chlorometrisches Reagens empfohlen. Sein
Verfahren war aber sehr ungenau, denn er brachte die Chlorkalkaufloͤsung in
ein Standglas und goß von dem salpetersauren Queksilber so lange hinein, bis ein
Niederschlag entstand, welcher durch Umruͤhren nicht mehr verschwand.
Spaͤter, im Jahre 1831, empfahl auch Hr. Marozeau das
salpetersaure Queksilber zu diesem ZwekePolytechn. Journal Bd. XLI. S.
258., aber auf eine zwekmaͤßigere Weise, denn er schrieb vor, den
Chlorkalk in das salpetersaure Queksilber zu gießen. Durch diese Abaͤnderung
wurde lezteres Salz als chlorometrisches Reagens anwendbar; dessen ungeachtet kam es
bis jezt gar nicht in Gebrauch, was dem Umstande zugeschrieben werden muß, daß er
den Fabrikanten nicht alle Vorsichtsmaßregeln angab, welche zum Gelingen dieser
Methode noͤthig sind.
Das salpetersaure Queksilberoxydul ist leicht zu bereiten; man loͤst
naͤmlich 18,124 Gr. Queksilber in der Kaͤlte in ungefaͤhr 200
Kubikcentimeter Salpetersaͤure von 22° Baumé auf und
verduͤnnt kann die Fluͤssigkeit bis auf das Volum eines Liters mit
Wasser. Da man aber nicht sicher ist, daß alles Queksilber auf der ersten
Oxydationsstufe blieb, so muß man die Fluͤssigkeit auf ihre Staͤrke
probiren, ehe man sie anwendet. Deßwegen waͤre es auch unnuͤz, zu
kleinliche Vorsichtsmaßregeln bei der Bereitung der Queksilberaufloͤsung zu
beobachten, indem es gleichguͤltig ist, ob sie Oxydsalz enthaͤlt oder
nicht; lezteres Salz hat naͤmlich auf das Resultat bei der Chlorprobe keinen
Einfluß, obgleich Hr. Marozeau das Gegentheil
behauptete.
Bemerkungen uͤber die drei beschriebenen
chlorometrischen Methoden.
Obgleich alle drei Methoden bei sorgfaͤltiger Manipulation in der
Zuverlaͤssigkeit sich gleichstehen, so geben wir doch dem Verfahren mit der
arsenigen Saͤure den Vorzug, und zwar wegen der sehr in die Augen fallenden
Angabe des Saͤttigungspunktes.
Jede der drei Normalaufloͤsungen ist hinreichend bestaͤndig. Als ich
eine Aufloͤsung von arseniger Saͤure mehr als sechs Monate mit reinem
Sauerstoffgas in Beruͤhrung ließ, absorbirte sie nur sehr wenig davon. Mit
der atmosphaͤrischen Luft ist die Absorption noch geringer. Um
uͤbrigens auch den geringsten Verdacht einer Veraͤnderung zu
vermeiden, kann man die Arsenikaufloͤsung, nachdem man sie auf ihre
Staͤrke probirt hat, in Flaschen, die ein halbes Liter fassen, aufbewahren,
diese ganz damit fuͤllen und mit einem eingeriebenen Stoͤpsel
verschließen, der zuvor mit Talg bestrichen wurde. Eine Flasche von einem halben
Liter reicht fuͤr fuͤnfzig Proben aus.
Das Cyaneisenkalium scheint nicht der geringsten Veraͤnderung faͤhig zu
seyn, besonders in festem Zustande; man bewahrt es daher zu den Chlorproben, nachdem
es auf seine Staͤrke untersucht wurde, in gepulvertem Zustande in gut verschlossenen Flaschen
auf. Man koͤnnte es sogar in Pakete fuͤr einen Liter Aufloͤsung
vertheilen.
Das salpetersaure Queksilberoxydul scheint sich mit der Zeit zu veraͤndern,
aber sehr langsam, und ohne daß dadurch die Genauigkeit der Chlorproben
beeintraͤchtigt werden koͤnnte, wenn man naͤmlich die Vorsicht
gebraucht, es in genau verschlossenen Flaschen, die einen halben Liter fassen,
aufzubewahren.
Bei Anwendung einer schwach blau gefaͤrbten Aufloͤsung von arseniger
Saͤure wird die Fluͤssigkeit in dem Moment, wo die Reaction beendigt
ist, vollstaͤndig entfaͤrbt und wasserhell. Bei dem Cyaneisenkalium
wird das Ende der Reaktion, jedoch mit nicht so großer Schaͤrfe, durch den
Uebergang der gruͤnen Faͤrbung in die gelbe angezeigt; bei einiger
Uebung kann man jedoch in dieser Hinsicht keinen merklichen Irrthum begehen. Bei dem
salpetersauren Queksilber erkennt man das Ende der Operation an dem Verschwinden des
gefaͤllten Queksilberchloruͤrs, ohne daß man noͤthig
haͤtte, die Fluͤssigkeit mit Indigaufloͤsung zu faͤrben;
obgleich hiebei die Angabe des Saͤttigungspunktes nicht so in die Augen
fallend ist, wie bei der Arsenikaufloͤsung, so ist sie es doch in solchem
Grade, daß man gegen das Verfahren nichts einwenden kann. Es liegt wenig daran, ob
das Chloruͤr frei von schwefelsauren Salzen ist, oder nicht, denn das
schwefelsaure Queksilber wird eben so leicht wie das Chloruͤr zersezt und in
Chlorid umgeaͤndert.
Die Verduͤnnung der zu pruͤfenden Bleichfluͤssigkeit hat auf das
Resultat gar keinen Einfluß. Ich erhielt mit einem 100° starken
Chloruͤr genau dasselbe Resultat, wie nach der Verduͤnnung desselben
mit seinem vierfachen Volum Wasser, wodurch also sein Gehalt auf 20° reducirt
worden war. Auch zeigte sich kein merklicher Unterschied, als die Probe mit
Blutlaugensalz und mit salpetersaurem Queksilber wiederholt wurde.
Pruͤfung des kaͤuflichen
Braunsteins.
Der kaͤufliche Braunstein ist nie reines Mangansuperoxyd, und man muß daher
den wahren Gehalt desselben an Mangansuperoxyd bestimmen koͤnnen.
Das Verfahren, welches am besten gelingt und uͤberdieß unmittelbar zum Zwek
fuͤhrt, besteht darin, das Chlorgas, welches ein constantes Gewicht
Braunstein liefern kann, von alkalischem Wasser absorbiren zu lassen und dann
chlorometrisch zu pruͤfen. Da aber die Apparate einen großen Einfluß auf die
Genauigkeit der Resultate haben und in den Fabriken nur dann ein Verfahren in
Gebrauch kommt, wenn es leicht ausfuͤhrbar ist, so bemuͤhte ich mich,
es so einzurichten, daß
es allen Anforderungen in Bezug auf Genauigkeit sowohl als Einfachheit
entspricht.
Von chemisch reinem Mangansuperoxyd sind gerade 3,980 Gr. erforderlich, um 1 Liter
troknen Chlorgases (bei 0° und 0,760 Barom.) zu liefern; man braucht daher
nur 3,980 Gr. reinen Mangansuperoxyds mit Salzsaͤure zu erhizen, das
entwikelte Chlorgas von alkalischem Wasser absorbiren zu lassen, und das Volum der
Fluͤssigkeit durch Verduͤnnung auf 1 Liter zu bringen, um eine
Normalfluͤssigkeit von 100° zu erhalten. Wenn man nun von dem zu
pruͤfenden Braunstein ein gleiches Gewicht eben so behandelt, so
erhaͤlt man ein Chloruͤr, dessen Chlorgehalt genau dem
Sauerstoffgehalte des Manganoxyds entspricht. Betraͤgt der Gehalt des
Chloruͤrs z.B. 50°, so zeigt dieß an, daß der angewandte Braunstein
nur halb so viel Chlor liefern kann, als reines Mangansuperoxyd und daß, wo von
diesem lezteren ein Gewicht P noͤthig
waͤre, von jenem ein Gewicht P 100/50 angewandt
werden muͤßte, um dasselbe Quantum Chlor zu erhalten.
Hr. Robiquet hat im Dict.
technol. meine Apparate zu diesen Proben beschrieben; ich habe sie aber
seitdem verbessert. Anstatt einer langen und sehr geneigten Glasroͤhre von
großem Durchmesser, worin ich das Chlor mittelst einer Kalkmilch oder
Kaliaufloͤsung sammelte, bediene ich mich jezt eines Kolbens 8, der
ungefaͤhr einen halben Liter faßt und einen langen und sehr weiten Hals hat.
Ich will aber den ganzen Apparat beschreiben.
t ist ein kleiner Kolben von ungefaͤhr 5
Centimeter Durchmesser, in welchen der mit Salzsaͤure zu behandelnde
Braunstein kommt. Er wird auf einem kleinen Ofen mit Kohlen oder uͤber einer
Oehl- oder Weingeistlampe erhizt; in lezterem Falle darf man aber den Kolben
nicht unmittelbar der Einwirkung der Flamme aussezen, sondern muß ihn mit einem
Gehaͤuse von Eisenblech umgeben, welches die Waͤrme empfaͤngt
und vertheilt.
u ist eine Roͤhre von kleinem Durchmesser, die so
viel als moͤglich gebogen ist, ohne daß ihre Kruͤmmung sie verhindert
in den Kolben S zu gehen. Sie ist am kleinen Kolben t mittelst eines Korkpfropfs angebracht, dessen Poren
mit einem aus Mehlkleister und Mandelteig bereiteten Kitt verstopft wurden. In
seinem oberen Theile ist der Korkpfropf kegelfoͤrmig ausgehoͤhlt; man
bringt darin weißes Wachs zum Schmelzen, worauf zwischen der Roͤhre und dem
Pfropf kein Gas mehr entweichen kann.
Der Kolben S, welcher ungefaͤhr einen halben Liter
faßt, wird bis zum Anfang des Halses mit einer Kali- oder
Natronaufloͤsung gefuͤllt, die 200 alkalimetrische Grade zeigt, also
uͤber doppelt so viel als zur Bildung eines neutralen Chloruͤrs
noͤthig sind; denn ein Liter Chlor entspricht nur 88 alkalimetrischen
Graden.Gay-Lussac's Anleitung zur Alkalimetrie
findet man im Polytechn. Journale Bd.
XXXII. S. 190.A. d. R.
T ist eine Roͤhre, welche bis i 25 Kubikcentimeter faßt und womit die
Salzsaͤure zum Aufloͤsen des Manganoxyds gemessen wird.
Verfahren.
Man wiegt von dem zu pruͤfenden Braunsteine eine aus allen Theilen der Masse
desselben ausgewaͤhlte und sein pulverisirte Probe von 3,980 Gr. auf einem
laͤnglich-vierekigen Stuͤk Papier ab, rollt das Papier zusammen
und schuͤttet den Braunstein, indem man das Papier tief in den Hals des
kleinen Glaskolbens stekt, in diesen hinein, wobei man Sorge traͤgt, daß
nichts am Papier haͤngen bleibt. Auch kann man den Braunstein durch einen
Trichter mit weiter Oeffnung hineinbringen. Dann gießt man 25 Kubikcentimeter
rauchender Salzsaͤure in den Kolben und befestigt darauf sogleich den Kork
der Roͤhre u, die bereits mit dem Kolben 8
verbunden ist. Das Chlor faͤngt sogleich an sich zu entwikeln und treibt die
Luft des kleinen Kolbens vor sich her, welche sich im oberen Theile des großen, der
als Vorlage dient, ansammelt und aus dessen Bauch einen Theil der Lauge
verdraͤngt; damit dieß nicht zum Uebersteigen gehe, schuͤttelt man den
großen Kolben von Zeit zu Zeit um, damit das beigemengte Chlor absorbirt wird, und
laͤßt die Luft durch eine passende Bewegung aus dem Bauche desselben
entweichen; wenn aber der kleine Kolben im Verhaͤltnisse zum großen sehr
klein ist, so ist dieß nicht einmal noͤthig. Nun beschleunigt man die
Chlorentbindung durch allmaͤhliche Erhizung des Kolbens und bringt endlich
die Fluͤssigkeit in voͤlliges Kochen; der dadurch erzeugte Dampf
treibt vollends alles Chlor uͤber. Sobald sich die
Gasentbindungsroͤhre bis an die Stelle, wo sie in die Lauge taucht, erhizt
hat, ist die Operation beendigt; man nimmt den großen Kolben schnell ab, damit die
Fluͤssigkeit nicht zuruͤksteige, gießt die Fluͤssigkeit aus
demselben in das einen Liter fassende Gefaͤß Q,
schwenkt den Kolben oͤfters mit Wasser aus, sezt dieses der
Fluͤssigkeit zu, macht durch Wasser das Maaß des Liters voll und
ruͤhrt um. Man braucht dann nur noch die Staͤrke der
Chloraufloͤsung nach einer der beschriebenen Verfahrungsarten zu
bestimmen.
Wenn jedoch der Werth eines Braunsteins genau bestimmt werden soll, so reicht es
nicht hin, das Quantum Chlor zu kennen, welches er liefert, sondern man muß auch die
Menge der consumirten Salzsaͤure bestimmen. Bei reinem Manganhyperoxyd wird allerdings die
Haͤlfte der Salzsaͤure zersezt und als Chlor ausgeschieden;
waͤre aber das Mangan z.B. auf der Stufe des Sesquioxyds, so wuͤrde
von 3 Theilen angewandter Saͤure nur einer in Chlor verwandelt; wenn endlich
der Braunstein Eisen, Baryt etc. enthaͤlt, so neutralisiren diese
fremdartigen Koͤrper ebenfalls eine entsprechende Menge
Salzsaͤure.
Die Quantitaͤt Salzsaͤure, welche im Verhaͤltniß zu der des
erhaltenen Chlors consumirt wurde, laͤßt sich uͤbrigens leicht
bestimmen. Um 3,980 Gr. chemisch reines Mangansuperoxyd aufzuloͤsen, bedarf
man einer Menge Salzsaͤure, welche 175,72 alkalimetrischen Graden entspricht;
davon ist die Haͤlfte noͤthig, um das Manganoxydul aufzuloͤsen,
die andere Haͤlfte aber wird zersezt und liefert 1 Liter Chlors
aufloͤfung von 100°. In der That geschieht aber die Zersezung nicht so
vollstaͤndig, sondern es bleiben selbst bei einem Ueberschuß von reinem
Mangansuperoxyd etwa 5 Procent Salzsaͤure unzersezt.
Ich behandelte naͤmlich 8 Gramm Braunstein mit 25 Kubikcentimeter
Salzsaͤure, welche 285°,7 des Alkalimeters entsprachen und erhielt 1
Liter Chloraufloͤsung von 152°,1, was 267°,27 des Alkalimeters
entspricht (da 1 Liter Chloraufloͤsung von 100° des Chlorometers =
175,72 alkalimetrischen Graden ist); die in der Retorte ruͤkstaͤndige
Fluͤssigkeit bedurfte noch 15 alkalimetrische Grade kohlensauren Natrons zur
voͤlligen Saͤttigung; dieß macht 282°,27, so daß also der
Verlust = 2°,43 (ungefaͤhr 1 Proc.), die Menge der unzersezten
Salzsaͤure aber 10° (ziemlich 5 Proc.) betrug.
Um nun die bei einer Braunsteinpruͤfung consumirte Menge von Salzsaͤure
zu beurtheilen, waͤhlt man zur Aufloͤsung von 3,98 Gr. des
Mangansuperoxyds immer 25 Kubikcentimeter Salzsaͤure, welche 250,2
alkalimetrischen Graden entsprechen; aus dem Grade der erhaltenen
Chloraufloͤsung berechnet man die entsprechenden alkalimetrischen Grade der
Saͤure (wobei 100° der Chloraufloͤsung = 175°,72 der
Saͤure); saͤttigt den Ruͤkstand in der Retorte
sorgfaͤltig mit kohlensaurem NatronIch habe mich uͤberzeugt, daß das Eisenchlorid durch das
Mangansuperoxyd nicht zersezt wird, so daß man also durch die Neutralisation
des Retortenruͤkstandes wirklich alle in der Fluͤssigkeit
zuruͤkgebliebene Saͤure bestimmen kann.A. d. O. und bemerkt die Menge des lezteren ebenfalls nach alkalimetrischen Graden.
Addirt man nun die beiden gefundenen Groͤßen und zieht die Summe von 250 ab,
so gibt der Rest die Anzahl Grade der Salzsaͤure an, welche verloren gegangen
sind. Folgendes sind die Resultate der Pruͤfung mehrerer
Braunsteinsorten:
Braunsteinsorte.
Grad
der erhaltenenChloraufloͤs.
Entsprechender Salzsaͤuregrad.
Kohlensaures
Natron zur
Saͤttig. d. Retortenruͤkstand.
Also Verlust an.
Saͤure.
Deutscher Braunstein, krystallinisch
95°,2
167°,3
79°,0
3°,0
Braunstein von Mayenne,
leichtloͤslich in Salzsaͤure, etwas
barythaltig
52°,2
92°,2
127°,0
31°,0
Braunstein von Bourgogne, sehr
leichtloͤslich
68°,5
120°,4
103°,0
26°,8
Braunstein von Dordogne, baryt- und
eisenhaltig
68°,1
119°,7
103°,0
27°,5
Braunstein von Cher, wenig
eisenhaltig, mit gruͤner Farbe und
sandigem Ruͤkstande loͤslich
53°,5
94°,0
147°,0
9°,2
Braunstein von England
87°,9
154°,4
82°,0
13°,8
Da diese Pruͤfung, welche troz aller Verunreinigung des Braunstein stets ein
sicheres Resultat gibt, die Menge von Braunstein und Salzsaͤure berechnen
laͤßt, welche zur Erzeugung eines bestimmten Volums Chlor noͤthig
sind, so liefert sie die vollstaͤndigen Mittel zur Berechnung der Kosten des
Chlors an die Hand.
Ich habe die Menge des nuzbaren Sauerstoffs in den Braunsteinsorten auch durch die
Quantitaͤt Kupfer zu bestimmen versucht, welche sich mit ihrer Huͤlfe
in verduͤnnter Schwefelsaͤure aufloͤst; da ich aber
spaͤter fand, daß das Eisenoxyd gerade so wie die Manganoxyde die
Aufloͤsung des Kupfers in Schwefelsaͤure beguͤnstigt, so wußte
ich dieser Methode entsagen.
Wichtige Bemerkung uͤber die anzuwendende
Salzsaͤure.
Zu den chlorometrischen Versuchen soll man nur chemischreine Salzsaͤure
anwenden; wenigstens muß sie durchaus frei von schwefliger Saͤure seyn; indem
diese das Chlor in Salzsaͤure umaͤndert, wodurch das Resultat
fehlerhaft ausfallen wuͤrde. Die kaͤufliche Salzsaͤure
enthaͤlt fast immer schweflige Saͤure und oft in nicht unbedeutender
Menge. Um zu erfahren ob sie solche und wie viel sie davon enthaͤlt, bedient
man sich einer Chlorkalkaufloͤsung von bekannter Staͤrke, die man in
ein Maaß mit Indigaufloͤsung schwach blau gefaͤrbter Salzsaͤure
gießt, indem man uͤbrigens gerade so verfaͤhrt, als wenn man die
Arsenikaufloͤsung pruͤfen wollte. Die schweflige Saͤure wird
zuerst zerstoͤrt und die blaue Farbe verschwindet erst in dem Augenblik, wo
das Chlor in Ueberschuß ist. Wenn durch den ersten Tropfen
Chlorkalkaufloͤsung die der Salzsaͤure ertheilte blaue Farbe verschwindet, so
enthaͤlt diese Saͤure keine schweflige Saͤure; braucht man aber
davon z.B. 6°, so enthaͤlt die Salzsaͤure schweflige
Saͤure und ziemlich nahe 6 Procent ihres Volums; denn ein Volum
schwefligsauren Gases entspricht beinahe einem Volum Chlor. Man kann sich also der
schwefligen Saͤure in der Salzsaͤure leicht dadurch entledigen, daß
man sie mit einem geeigneten Volum Chlorkalkaufloͤsung vermischt; da sie aber
dadurch verduͤnnt wird, so thut man besser, so lange Chlorgas hinein zu
leiten, bis alle schweflige Saͤure zerstoͤrt ist. Die
Salzsaͤure ist frei von schwefliger Saͤure, wenn ein Tropfen
Chlorkalkaufloͤsung die indigblaue Farbe, welche man ihr ertheilte,
augenbliklich zerstoͤrt und sie ist frei von Chlor, wenn sie selbst diese
Farbe nicht bleicht.
Tafeln