| Titel: | Ueber technische Leuchtgas-Analyse durch Messung und titrirte Lösungen; von Dr. Adolph Richter. |
| Autor: | Adolph Richter |
| Fundstelle: | Band 186, Jahrgang 1867, Nr. XC., S. 395 |
| Download: | XML |
XC.
Ueber technische Leuchtgas-Analyse durch
Messung und titrirte Lösungen; von Dr. Adolph Richter.
Mit Abbildungen auf Tab.
VIII.
Richter, über technische Leuchtgas-Analyse durch Messung und
titrirte Lösungen.
Bei Analysen des Leuchtgases für technische Zwecke sind es namentlich zwei
Gesichtspunkte, welche in's Auge gefaßt werden: entweder die Nachweisung der
Existenz, beziehungsweise Nichtexistenz der verunreinigenden Bestandtheile und
hiermit verbundene Controle der Reiniger oder Reinigungsmassen, oder die Ermittelung
des Verhältnisses der verdünnenden zu den leuchtenden Bestandtheilen, um hieraus den
relativen Werth des Gases ohne Photometer zu bestimmen, oder die Zeit zu ermessen,
welche die eine oder andere Kohlensorte bedarf, um mit möglichster Ausnutzung
gleichzeitig ein gutes, leuchtendes Gas zu liefern, da bekanntlich die
procentualische Zusammensetzung des Gasgemenges während der Dauer der
Beschickungszeit eine immer wechselnde ist, und gegen Ende der Operation nur noch
Wasserstoff erzeugt wird.
Zu der ersten Kategorie gehören die mannichfachen Apparate zur Kohlensäurebestimmung,
welche in den verschiedenen Fabriken zur Anwendung kommen. In der That ist auch
dieser Bestandtheil des Gases einer der gefährlichsten, da er durch seine
Eigenschaft, mit glühender Kohle zusammen zu treten um Kohlenoxyd zu bilden, den
Leuchtwerth des Gases außerordentlich herabstimmt, indem das Elayl bekanntlich beim
Glühen in Sumpfgas und Kohlenstoff zerfällt und letzterer ein ihm gleiches
Aequivalent Kohlensäure zu Kohlenoxyd reducirt. So kann man annehmen, daß die
Kohlensäure etwa ihr halbes Volum Elayl der Leuchtkraft beraubt, weil das Kohlenoxyd
mit nicht leuchtender Flamme brennt.
Zu der zweiten Kategorie gehören die Apparate zur specifischen Gewichtsbestimmung, so
namentlich der von Schilling angegebene, welcher auf dem
Bunsen'schen Principe beruht, daß die spec. Gewichte
zweier Gase, welche unter gleichem Druck trocken durch eine feine Oeffnung
ausströmen, sich umgekehrt wie die Quadrate der Ausströmungsgeschwindigkeiten
verhalten.
Eine vollständige oder annähernd vollständige Analyse erforderte jedoch bisher sehr
geübte Hände und lange Zeit, um die durch Bunsen für
wissenschaftliche Zwecke vervollkommneten Methoden anzuwenden, war also für
technische Anwendungen nahezu unzugänglich.
Um rasch auszuführende Bestimmungen der Bestandtheile des Gases in einer für den
Techniker genügenden Genauigkeit zu ermöglichen, mußte zunächst die Dauer der
einzelnen Versuche so abgekürzt werden, daß man Wasser statt des theuren,
umständlich zu behandelnden Quecksilbers in Anwendung bringen kann, ohne durch die
Diffusion Ungenauigkeiten befürchten zu müssen.
Die Operationen und Apparate müssen einfach seyn, und die Formeln der Berechnung so
einfach, daß man die Arbeit getrost jedem intelligenten Werkführer anvertrauen
kann.
Nachstehende Methoden, welche nach Angaben des Hrn. Geheimraths Bunsen in dessen Laboratorium und der
Heidelberger Gasfabrik vor mehreren Jahren entstanden, dürften dem erwähnten Zwecke
wenigstens soweit entsprechen, daß sie den Gastechnikern von einigem Nutzen seyn
können. Viele in London und in mehreren deutschen Städten damit angestellte Versuche
haben wenigstens übereinstimmende und im Ganzen recht befriedigende Resultate
ergeben. Bei einiger Uebung gestatten dieselben die schädlichen Beimengungen des
Gases ebenso rasch zu bestimmen, als das Gas bei gewöhnlichem Betrieb die Reiniger
durchstreicht, wodurch nich unwichtige Beiträge zur Statik der Gasbereitung und zur
Beurtheilung der Functionen der einzelnen dabei gebräuchlichen Apparate erhalten
werden können.
Die Bestandtheile des rohen Leuchtgases kann man in drei Abtheilungen bringen:
1) Lichtgeber;
2) Lichtträger;
3) Verunreinigungen.
Zu 1) gehören a) die
Kohlenwasserstoffe der Formel C²ⁿH²ⁿ; b) Dämpfe gewisser Basen, wie Naphtalin etc.
Zu 2) gehören Wasserstoff, Grubengas, Kohlenoxyd.
Zu 3) gehören Kohlensäure, Ammoniak, Schwefelwasserstoff,
Schwefelkohlenstoff, sowie aus der atmosphärischen Luft stammend Stickstoff und
Sauerstoff in kleinen Mengen.
Bei gut geleiteter Condensation kommen natürlich nach den Luftcondensatoren und dem
Scrubber jene sub 1 b
erwähnten Dämpfe nicht mehr bei einer Analyse in Betracht und könnten überdieß durch
Säure eventuell aus dem zu untersuchenden Gase entfernt werden; die übrigen
Bestandtheile werden sämmtlich bestimmt, oder nach Bedarf auch gesondert, wenn es
sich nur um die Ermittelung des einen oder anderen handelt, und hierin liegt gerade
ein Vortheil der Methoden, daß nicht alle Operationen eine gemeinsame Kette bilden.
Wenn es auch scheinen sollte, daß die Bestimmung des Kohlenoxydes, des
Methyl- und des einfachen Wasserstoffes sowie der schweren Kohlenwasserstoffe
nicht getrennt werden können, so zeigt doch eine nähere Betrachtung, daß auch hier
jeder Bestandtheil in der unten stehenden Beschreibung der Bestimmung dieser Körper
mit Umgehung der quantitativen Bestimmung seiner Vorgänger ermittelt werden kann,
indem man diese in Röhren oder Kolben mit den betreffenden Absorptionsmitteln
zusammenbringt und so eliminirt, wie dieß z.B. bei der Bestimmung von
(C²ⁿH²ⁿ mit dem Ammoniak, der Kohlensäure und dem
Schwefelwasserstoff geschieht.
Die zu dem Titriren nöthigen Lösungen bereitet man sich in größerer Menge und
verwahrt sie am besten in Säureballons, welche auf einem Repositorium über dem
Arbeitstische stehen. In die Gummistopfen der Ballons bringt man zwei Glasröhren,
von welchen die eine nur eben durch den Stopfen reicht, die andere beinahe bis zum
Boden des Ballons führt und äußerlich mit einem herunterhängenden Glasrohre in
Verbindung steht, welches als Heber dient und mit einem Stückchen Kautschukschlauch
und mit Quetschhahn versehen ist. Bei den Kalk- oder Barytlösungen befestigt
man an das kürzere Rohr noch ein Waschfläschchen mit Natronlauge. Ueber zweckmäßige,
aus den Versuchen sich ergebende Verdünnungsgrade der Titrirungsflüssigkeiten können
die am betreffenden Orte angegebenen Zahlen Anhaltspunkte bieten.
Es bedarf wohl kaum noch der Erwähnung, daß die Luft als größter Feind zu betrachten
und Luftbläschen in den Apparaten und Röhren mit großer Sorgfalt zu entfernen sind; ebenso muß bei
Anwendung der Kalk- oder Barytlösung der im unteren Theile des Heberrohres
stehende Theil Flüssigkeit entfernt werden, weil sich am Quetschhahn immer etwas
kohlensaures Salz absetzt, welches jedoch leicht herausgespült wird.
Wir gehen nun zur Beschreibung der einzelnen zur Analyse dienenden Operationen
über.
1. Bestimmung der
Kohlensäure.
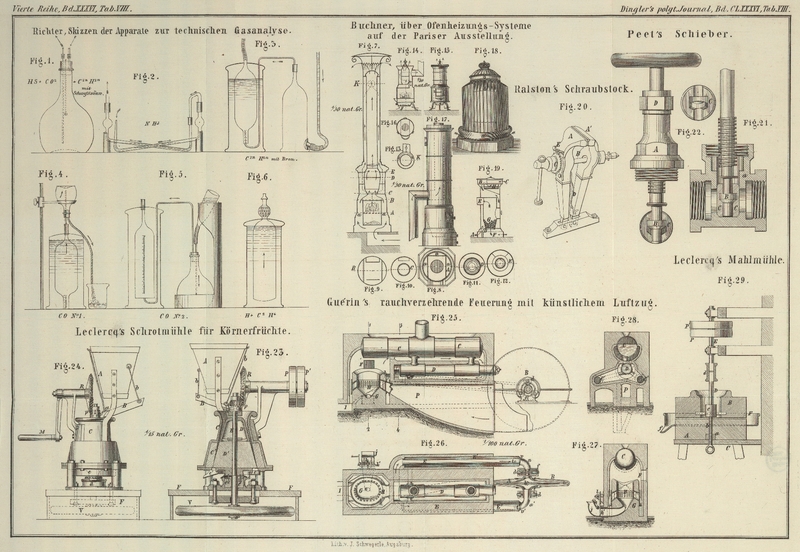
Diese Bestimmung wird in einem Glaskolben (Fig. 1) von 2500 bis 3000
Kubikcentimetern Inhalt ausgeführt, welcher mit einem dreifach durchbohrten
Kautschukstopfen verschlossen ist. Durch zwei Durchbohrungen des Stopfens gehen
Glasröhren, von welchen eine fast zum Boden des Ballons, die andere nur bis zum
unteren Ende des Stopfens hinab reicht. Nachdem der Stand des Stopfens im Halse des
Kolbens und der Stand der Röhren im Stopfen durch Marken ein für allemal fixirt
worden ist, wird der Inhalt des Ballons und der Röhren bis zu ihrem äußersten Ende
bei gewöhnlicher Temperatur bestimmt, und bei allen Untersuchungen Stopfen und
Röhren in die normale Stellung gebracht. Der Verschluß der Röhren wird durch ein
Stück Kautschukschlauch mit einem halbzölligen Stückchen Glasstab von der Dicke der
Röhren leicht und sicher bewerkstelligt. Durch die dritte Bohrung des Stopfens geht
ein kleines Thermometer, welches natürlich schon vor der Ausmessung des Kolbens
eingebracht wird.
Mit diesem Apparate wird die Kohlensäurebestimmung leicht ausgeführt, indem man das
kürzere Glasrohr mittelst eines Gummischlauches mit der Gasleitung oder dem
Gasbehälter in Verbindung setzt und durch Drücken der Schlauchstücke, welche die
Glasstabventile enthalten, diese Ventile öffnet. Man kann auch diese
Glasstabstückchen ganz entfernen und erst nach dem Füllen des Kolbens einführen. Man
schließt alsdann zuerst das längere und darauf das kurze Rohr. Die Zeit des
Einleitens beträgt gewöhnlich 10 Minuten. Hierauf wird mit einer Pipette eine
abgemessene Menge Kalk- oder Barytwasser eingebracht, indem man die Pipette
mit dem kürzeren Rohre verbindet und das Ventil öffnet; zeitweilig öffnet man auch
das andere Ventil, um den Druck auszugleichen, worauf eine neue Menge Flüssigkeit
einströmt.
Hierauf wird der Kolben geschüttelt, um die Kohlensäure zu absorbiren, in eine
Bürette filtrirt und ein abgemessener Theil mit titrirter Salzsäure neutralisirt.
Diese Operation kann sehr rasch ausgeführt werden, da man nur einen Theil des
Filtrates zu titriren nöthig hat, welchen man auf's Ganze berechnet; und so kann die
Bildung von kohlensaurem
Baryt oder Kalk durch die Luft als unerheblich betrachtet werden.
Zur Berechnung der Resultate ist gegeben:
s
=
spec. Gewicht der Kohlensäure,
T
=
abgelesene Temperatur des Gases im Kolben,
p
=
Tension welche dieser Temperatur entspricht,
R
=
Volum des Kolbens in Kubikcentimetern,
V
=
Volum der Kalk- oder Barytlösung, welche man in denKolben
brachte,
v
=
zum Titriren genommenes Volum derselben,
α
=
Menge der Salzsäure in einem Bürettengrade,
t'
=
Anzahl Bürettengrade von Salzsäure, welche man vor derAbsorption der
Kohlensäure zur Neutralisation des Volums vnöthig hätte,
t
=
Anzahl der Bürettengrade, welche nach der Absorption
zurNeutralisation nöthig sind.
Man findet dann:
V/v t' = Anzahl der
Bürettengrade, nothwendig zur Neutralisation des Volums V.
V/v . αt' der Salzsäuremenge in Grammen, welche das Volum V nöthig hat.
V/v α (t' – t)Gewicht der
Salzsäure, entsprechend der durch die Kalklösung gefällten Kohlensäure.
CO²/HCl . V/v α (t' – t) Gewicht der Kohlensäure im Volum R – V.
0,773/s . CO²/HCl. V/v . α (t' – t) Volum der
Kohlensäure in Kubikcentimetern bei der vorhandenen Temperatur.
1000/(R – V) . 0,773/s . CO²/HCl . V/v . α (t' – t) Volum der
Kohlensäure bei 0° und 0,76 Meter Druck in 1000 Theilen Gas von der
Temperatur T und dem Drucke P – p.
773/s . 760/(R – V) . CO²/HCl . V/v α (t' – t) . (1 +
0,00366T)/(P –
p) Volum der Kohlensäure von 0° und 0,76
Meter Druck in 1000 Theilen Gas von derselben Temperatur und demselben Druck.
Nehmen wir z.B. folgende Größen als gegeben an:
R = 2544
V = 50
s = 1,529
CO² 0 22
HCl = 36,5
α = 0,0017
760/(R – v) . 773/s . V/v α . CO²/HCl =
0,3
so findet man v die zur Titrirung
zu nehmende Menge = 39,7 Kubikcentimeter. Markirt man nun ein Gefäß, in welches
filtrirt werden soll, auf 39,7 K. C. und titrirt jedesmal dieses Quantum, so ergibt
sich der Promille-Gehalt des Gases an Kohlensäure direct aus der Ablesung
nach der Formel:
k = (1 + 0,003966 T)/(P – p) . 0,3 (t' – t)
von welcher der erste Theil in den bekannten Tabellen sofort
als fester Werth gefunden wird.
Auf diese Weise kann für jeden Apparat eine einfache Formel leicht berechnet
werden.
2. Bestimmung des
Schwefelwasserstoffes.
Um diese Bestimmung auszuführen, bedient man sich eines Kolbens von genau derselben
Construction wie der zur Kohlensäurebestimmung, gebrauchte und von ähnlicher Größe
(Fig. 1);
nachdem man denselben in der bei I) beschriebenen Weise mit Gas angefüllt hat,
schließt man die Quetschhähne und bringt mit einer Pipette eine gemessene Quantität
titrirte Ammoniaklösung in den Kolben. Hierauf wird der innere Druck mit dem äußeren
egalisirt und der Kolben gehörig geschüttelt. Der Kolbeninhalt wird sodann in ein
Glas gebracht und der Kolben gut ausgespült und das Spülwasser mit der Flüssigkeit
vereinigt, oder man nimmt ein abgemessenes Quantum des Kolbeninhaltes und berechnet
nachher auf's Ganze. Die Titrirung geschieht mit einer Lösung von schwefelsaurem
Cadmium 3 (CdO, SO³) + 8 HO, wobei man die Endreaction mit Bleipapier
ermittelt. Wenn die Schwärzung schwach zu werden beginnt, macht man bei jedem
Kubikcentimeter-Zusatz zwei Tupfen, mit dem Glasstabe auf das Bleipapier und
schreibt die Zahl der Bürettengrade dazwischen, bis nachher bei der Vergleichung der
Nullpunkt ermittelt ist. Diese Operation ist einfach und selbst von ungeübten Händen
leicht erlernt.
Zur Berechnung der Resultate ist gegeben:
s
=
spec. Gewicht des Schwefelwasserstoffes,
R
=
Volum des Kolbens,
p
=
Tension, welche der beobachteten Temperatur (T) entspricht,
α
=
Gewicht in Grammen des schwefelsauren Cadmiums in
einemBürettengrade,
V
=
Volum des in den Kolben gebrachten Ammoniaks,
v
=
zur Titrirung genommenes Volum,
t
=
Anzahl Bürettengrade, um damit das Volum (v)
zu neutralisiren.
Hieraus ergibt sich:
αt = Gewicht des zur Neutralisation des Volums
(v) nothwendigen schwefelsauren Cadmiums.
V/v αt = Quantität
des schwefelsauren Cadmiums, welche zur Neutralisirung des Volums (V) erforderlich ist.
Textabbildung Bd. 186, S. 400
Gewicht des Schwefelwasserstoffes, welcher in dem Volum (R – V) enthalten
ist.
Textabbildung Bd. 186, S. 400
Gewicht des Schwefelwasserstoffes in 1000 Theilen Gas.
Textabbildung Bd. 186, S. 400
Volum des Schwefelwasserstoffes bei 0° und 0,76 Meter
Druck in 1000 Theilen Gas.
Textabbildung Bd. 186, S. 400
Volum des Schwefelwasserstoffes bei 0° und 0,76 Met.
Druck in 1000 Theilen Gas von derselben Temperatur und demselben Druck.
Nehmen wir nun folgende Größen als gegeben an:
α = 0,00175
s = 1,175
3 HS = 51
3(CdO, SO³) + 8 HO = 384
R = 2357
V =100
und setzen die Größe
Textabbildung Bd. 186, S. 400
so finden wir (v) die zum Titriren
zu nehmende Menge v = 49,4 Kubikcentimeter und der
Promille-Gehalt des Gases ergibt sich aus der Gleichung
k = (1 + 0,00366 T)/(P – p) . 0,1 t.
Auch hier ergibt also eine einfache Multiplication, beziehungsweise Addition der
Logarithmen sofort aus der Anzahl Bürettengrade den Promille-Gehalt des Gases
an Schwefelwasserstoff.
3. Bestimmung des Ammoniaks.
Zu dieser Bestimmung benutzten wir zwei Glasröhren von 0,015 Met. lichter Weite,
welche an beiden Seiten in derselben Richtung umgebogen waren, so daß das
Mittelstück etwa 0,26 Met. lang war (Fig. 2). Die beiden Enden
waren nicht rechtwinkelig zu dem Hauptrohre umgebogen, sondern so, daß, wenn sie
senkrecht standen, jenes eine schwache Neigung zum Horizonte hatte und das eine Ende
etwa 0,04 Met. höher als das andere stand.
An diesem erhöhten Ende, welches durch einen auf die Grundlage aufgeleimten Kork
festgehalten wurde, war das umgebogene Stück Rohr etwa 0,10 Met. lang und in der
Mitte zu einer Kugel aufgeblasen. Die beiden anderen aufgebogenen Rohrtheile waren
ebenso lang, jedoch ohne Kugel. Diese beiden Röhren waren so nebeneinander gestellt,
daß das eine Kugelstück neben ein glattes Rohrstück kam, welche dann durch einen
Kautschukschlauch verbunden wurden. Das andere glatte Rohrstück wurde mit der
Gasleitung in Verbindung gebracht. In den so vorbereiteten Apparat wird nun zu der
Ammoniakbestimmung sehr verdünnte Salzsäure gebracht, so daß dieselbe in beiden
Röhren bis über die Mitte steht. Das Gas läßt man in langsamem Strome durch die
Röhren streichen und mißt das durchgegangene Quantum desselben mittelst einer
Gasuhr, welche unmittelbar mit dem Ende des Apparates in Verbindung steht. Wenn man
das nöthige Quantum Gas durch die Röhren hat passiren lassen, schließt man den Hahn
und bringt den Inhalt der beiden Röhren in eine Porzellanschale, um ihn gut zu
mischen; alsdann mißt man ein bestimmtes Quantum davon ab und titrirt die nicht vom
Ammoniak neutralisirte Salzsäure mit einer Kalk- oder Barytlösung.
Zur Berechnung der Resultate sind uns folgende Größen gegeben:
s
=
spec. Gewicht des Ammoniaks,
α
=
Gewicht des Kalkes in einem Bürettengrad,
V
=
Volum des Gases bei T°C und P – p Druck (wie beobachtet wurde),
t'
=
Anzahl Bürettengrade, welche vor der Ammoniakabsorption
zurNeutralisation nöthig gewesen wären,
t
=
Anzahl Bürettengrade, welche nach der Ammoniakabsorptionerforderlich
waren.
Hieraus ergibt sich:
αt' = Gewicht des Kalkes entsprechend der
Salzsäure vor der Absorption.
αt = Gewicht des Kalkes entsprechend der
Salzsäure nach der Absorption.
α (t' – t) = Gewicht des Kalkes, welches dem absorbirten
Ammoniak äquivalent ist;
NH³/CaO . α (t' – t) = Gewicht
dieses Ammoniaks;
1000/v . NH³/CaO . α (t' – t) = Gewicht des Ammoniaks in 1000 Theilen Gas;
773/s . 1000/v . NH³/CaO . α (t' – t) = Volum des Ammoniaks von 0° C. und 0,76 Met. Druck in 1000
Theilen Gas;
Textabbildung Bd. 186, S. 402
Volum des Ammoniaks von 0° C. und 0,76 Met. Druck in
1000 Theilen Gas von demselben Druck und derselben Temperatur.
Bekannt sind nun folgende Größen:
s = 0, 5896
NH³ = 17
CaO = 28
α = 0,001346
Setzt man nun
760/V . 773/s . NH³/CaO . α = 0,01.
so ergibt sich für V der Werth
V = 81410 Kub. Centim. = 2,876 engl. Kubikfuß als
anzuwendende Menge des Gases, und der Promille-Gehalt des Gases an Ammoniak
ergibt sich aus der Formel:
k = (1 + 0,00366 T)/(P – p) . 0,1 (t' – t).
Die noch übrigen Bestandtheile des Gases werden mit ein und derselben Menge desselben der
Reihe nach bestimmt. Die erste Operation besteht in der
4. Bestimmung der schweren
Kohlenwasserstoffe (Elayl, Ditetryl).
Zu dieser Bestimmung bedient man sich entweder eines Cylinders oder eines Kolbens, je
nachdem man die Kohlenwasserstoffe durch Brom oder Schwefelsäure bestimmen will. Bei
der Anwendung von Schwefelsäure hat der Kolben dieselbe Einrichtung wie der zur
Kohlensäurebestimmung (Fig. 1). Zur Absorption
der Kohlenwasserstoffe verwendet man einen Cylinder von etwa 0,25 Met. Höhe und circa 0,06 Met. Durchmesser, welcher an seinem oberen
Ende zu der Dicke eines Glasrohres ausgezogen ist; derselbe hat an seinem unteren
Ende eine zweite Oeffnung etwa 0,02 Met. vom Boden, an welche ein Stück Glasrohr von
0,015 Met. Durchmesser und etwa 0,04 Met. Länge angeschmolzen ist. Diese sowie die
obere Röhre sind mit Gummiröhrchen versehen, in welchen Glasstabstücke von
entsprechender Dicke als Ventile stecken. Wenn man mit diesem Apparate (Fig. 3)
operiren will, so bringt man zuerst ein kleines Glaskügelchen, wie solche zu
Analysen organischer Flüssigkeiten üblich sind, nachdem man es vorher durch
vorsichtiges Erwärmen und Eintauchen der Spitze in Brom mit diesem Stoffe gefüllt
hat, durch die untere Oeffnung in den Cylinder. Alsdann läßt man das Gas, nachdem es
durch zwei Röhren – wie solche bei der Ammoniakalbestimmung (Fig. 2) zur Anwendung
kommen, und von denen die eine mit Natronlauge, die andere mit verdünnter Salzsäure
zur Hälfte angefüllt ist, – passirte, in langsamem Strome an der unteren
Oeffnung des Cylinders eintreten, bis derselbe ganz angefüllt ist, worauf man die
Hähne schließt.
Will man Schwefelsäure anwenden, so füllt man den hierzu dienenden Kolben (Fig. 1) in
derselben Weise, wie oben bei Kohlensäure und Schwefelwasserstoff angegeben wurde,
mit Gas, welches ebenfalls vorher die zwei eben erwähnten Röhren passirt hat. Ist
der Cylinder, beziehungsweise Kolben gefüllt, so wird durch Schütteln die Absorption
herbeigeführt. Nach erfolgter Absorption wird das Gas gemessen und zu diesem Zwecke
in einen Meßcylinder transportirt, welcher in ein größeres Gefäß mit Wasser taucht
und durch eine Stange mit verschiebbarer Klammer in jeder Höhe fixirt werden kann.
Auch dieser Cylinder (Fig. 3) ist an seinem
oberen Ende zu einer Röhre ausgezogen, welche durch Gummischlauch und Glasstabstück
verschlossen werden kann. Der obere Theil des Cylinders, etwa 16–18
Centimeter, hat dieselbe Weite wie der zur Absorption angewendete; der untere ist so
verengert, daß auf einer
angebrachten Scala halbe Kubikcentimeter abgelesen oder abgeschätzt werden können,
sein unteres Ende ist offen. Man verbindet nun, nachdem der Meßcylinder mit Wasser
gefüllt und in dem ihn umgebenden Wasser etwa zur Hälfte eintauchend fixirt wurde,
das obere dünne Ende des Absorptionscylinders mit einer mehrfach gebogenen
Glasröhre, welche mit Wasser angefüllt ist und mit ihrem anderen Ende unter dem
Meßcylinder endet. Das dicke Ansatzrohr des Absorptionscylinders wird ebenfalls mit
einem aufwärtsgehenden Rohre in Verbindung gebracht, welches mit der vorher zur
Absorption der Kohlensäure etc. dienenden Natronlauge gefüllt wurde und von oben
durch ein Reservoir oder durch Einschütten mit Wasser gefüllt erhalten werden kann.
Oeffnet man nun langsam die Hähne, so wird das Gas vollständig in den Meßcylinder
gedrückt und man kann es dort, nachdem man das innere und äußere Wasserniveau
ausgeglichen hat, unter Beobachtung der Temperatur und des Atmosphärendruckes
ablesen.
Setzen wir nun:
R
=
Volum des Absorptionscylinders,
v
=
Volum der Bromkugel,
A
=
Volum des Gases, welches von 1000 Theilen – nach Abzugder
Kohlensäure, des Schwefelwasserstoffes und Ammoniaks, welchegefunden
wurden – zurückbleibt,
t
=
Volum des Gases nach Absorption der Kohlenwasserstoffe,
so finden wir:
R – v = Volum des Gases im
Absorptionscylinder.
R – v – t = Volum der Kohlenwasserstoffe welche absorbirt
wurden.
A/(R – v) . R – v – t oder A (1 – t/(R – v)) = Volum der
Kohlenwasserstoffe in 1000 Theilen Gas.
Bei der Anwendung des Absorptionskolbens wird das längere Glasrohr mit dem Druckrohr
in Verbindung gebracht, und das Gas durch das kürzere, welches mit einer
Leitungsröhre verbunden wird, unter den Meßcylinder getrieben. Auch in diesem Falle
wird das Druckrohr anfangs mit Natronlauge gefüllt.
Auch hierbei ist:
R
=
Volum des Kolbens,
v
=
Volum der angewendeten Schwefelsäure,
A
=
Volum von 1000 Theilen Gas nach Abzug desSchwefelwasserstoffes, der
Kohlensäure und des Ammoniaks,
t
=
abgelesenes Gasvolum nach der Absorption.
Setzt man R = 98 und 1/(R
– v) = 0,012, so ergibt sich das anzuwendende
Volum Schwefelsäure
v = 14,7
hieraus ergibt sich der Promille-Gehalt des Gases an
den Kohlenwasserstoffen C²ⁿ H²ⁿ aus der Formel
k = A (1
– 0,012 t).
5. Bestimmung des
Kohlenoxyds.
Zur Ausführung dieser Operation benutzt man einen kleinen Kolben von 60–100 K.
C. Inhalt von derselben Einrichtung, wie die zur Bestimmung der Kohlensäure etc.
angewendeten. Dieser Kolben wird mit Wasser gefüllt und sein längeres Glasrohr mit
dem oberen schmalen Ende des bei der vorigen Bestimmung gebrauchten Meßcylinders
verbunden (Fig.
4). Das kürzere Glasrohr des Kolbens wird mit einem langen Gummischlauch
versehen; wenn man nun die Hähne öffnet, so strömt das Wasser durch dieses Gummirohr
aus und an seine Stelle tritt durch die andere Röhre das Gas. Um eine Verdünnung des
Gases durch das Ansaugen zu verhindern, wird der Cylinder ganz unter Wasser
getaucht, und das Gummirohr von Zeit zu Zeit mit den Fingern zusammengepreßt. Nach
der Füllung des Ballons wird durch das längere Glasrohr eine Lösung von
Kupferchlorür mit einer Pipette eingebracht und durch Schütteln das Kohlenoxyd
absorbirt.
Um das nach der Absorption übrig gebliebene Gas zu messen, wird dasselbe in einen
Meßcylinder gebracht, der von oben nach unten in 0,5 K. C. eingetheilt ist und sich
in der Größe nach dem Kolben richtet. Auch dieser Meßcylinder (Fig. 5) ist an seinem
oberen Ende zu einer Röhre ausgezogen und durch ein Stück Gummischlauch und Glasstab
verschlossen, und wird vor dem Einfüllen des Gases mit Wasser gefüllt in einen
weiteren auch mit Wasser gefüllten Cylinder eingetaucht. Das längere Rohr des
daneben stehenden Ballons wird mit einem Trichter oder anderen Wasserreservoir in
Verbindung gesetzt und an das kürzere ein gebogenes Glasrohr befestigt, dessen
unteres Ende in dem Wasser unter dem offenen Ende des Meßcylinders mündet. Dieses
Leitungsrohr wird auch vor seiner Verbindung mit dem Kolben mit Wasser gefüllt.
Oeffnet man nun die Hähne, so wird alles Gas in den Cylinder gepreßt und kann hier
nach dem Ausgleichen des Niveau's im inneren und äußeren Cylinder abgemessen
werden.
Nimmt man an:
R
=
Volum des Ballons,
v
=
Volum des Kupferchlorürs,
t
=
Volum des Gases im Meßcylinder,
A
=
Volum von 1000 Theilen Gas nach Abzug des Promille-Gehaltes an
CO²; HS, NH³ und C²ⁿH²ⁿ,
dann findet man den Promille-Gehalt des Gases an CO aus
der Formel
Textabbildung Bd. 186, S. 406
Setzt man nun
1/(R – v) = 0,02, so ist das anzuwendende Quantum Kupferchlorür
v = 12,1 K. C.
und hierdurch ergibt sich für k
der Werth
k = A (1
– 0,02 t).
6. Bestimmung des Wasserstoffes und
Methylwasserstoffes C² H⁴.
Zur Bestimmung dieser beiden Körper bringt man den Rest des Gases in einen Cylinder
von denselben Dimensionen wie der Meßcylinder, indem man das schmale Ende des
letzteren mit einem mit Wasser angefüllten Gasleilungsrohre verbindet, welches unter
dem gleichfalls mit Wasser angefüllten, zu dieser Bestimmung dienenden, unten
offenen Cylinder mündet (Fig. 6). Das obere Ende
dieses Cylinders ist zu einer Röhre ausgezogen, welche zu einer Kugel aufgeblasen
ist; diese Kugel enthält geschmolzenes Chlorcalcium, um das ausströmende Gas zu
trocknen. Am oberen Ende der Glasröhre ist ein Platinplättchen mit äußerst feiner
Oeffnung eingeschmolzen und außen am Cylinder sind zwei Marken, eine oben und eine
unten, angebracht. Hinter dem Cylinder hat man ein Pendel angebracht oder noch
besser eine Uhr, welche Secunden zeigt und Minuten schlägt. Der Cylinder wird
während des Einfüllens am oberen Ende durch ein Stück Gummischlauch und einen
Quetschhahn verschlossen gehalten und taucht selbstredend ganz in's Wasser, jedoch
so, daß man seine Marken von vorn genau sehen kann. Hat man nun schon vorher die
Anzahl Pendelschläge beobachtet, wenn man atmosphärische Luft aus dem Cylinder hat
ausströmen lassen, beziehungsweise die Zeit bestimmt, in welcher beim Ausströmen der
Luft das Niveau des Wassers im Cylinder von der unteren zur oberen Marke steigt, so
ergibt die Beobachtung der Anzahl Pendelschläge, welche bei der Ausströmung des
Gases erforderlich sind, damit das Wasser im inneren Cylinder denselben Weg
zurücklegt, das letzte Element der Gleichung, aus welcher das spec. Gewicht des
Gasgemenges ermittelt werden kann.
Es ist also gegeben:
v + v'
=
Volum des Wasserstoffes und Methylwasserstoffes,
v
=
Volum des C² H⁴,
v'
=
Volum des H,
S
=
spec. Gew. des Gemenges,
s
=
spec. Gew. des C²H⁴
s'
=
spec. Gew. des H,
A
=
Volum von 1000 Theilen Gas nach Absorption vonCO²; HS:
NH³; C²ⁿH²ⁿ und CO.
Man findet hieraus:
Textabbildung Bd. 186, S. 407
Da nun s = 0,5531,
und s' = 0,0693 ist, so finden wir
v' = 2,07 (0,553 – S)
A
v = A – v'.
7. Bestimmung des
Schwefelkohlenstoffes.
Nachdem man die Gegenwart dieses Körpers mit Triäthylphosphin (C⁴H⁵)³ P welchem er eine
prächtig rothe, leider nicht zu quantitativen Bestimmungen taugliche Verbindung
bildet, nachgewiesen hat, läßt man eine Quantität durch ein auf
300–400° erhitztes Porzellanrohr streichen, welches mit Aetzkalk (CaO)
angefüllt ist. Nachdem es hierauf einen Kühlapparat passirt hat, leitet man es in
den oben beschriebenen Apparat zur Schwefelwasserstoffbestimmung und bestimmt den
Schwefelwasserstoff in der bereits angegebenen Weise. Aller Schwefelkohlenstoff wird
in Schwefelwasserstoff durch den Kalk bei der Temperatur von 300 bis 400°
umgewandelt, und man hat nur nothwendig den vorhergefundenen Gehalt an
Schwefelwasserstoff von dem zuletzt gefundenen abzuziehen, um die Menge HS zu
finden, welche dem zerstörten Schwefelkohlenstoff entspricht. Es ist nun das
Aequivalent
HS = 17 und CS² = 38:
2HS geben 1 CS², daher folgt die Gleichung:
CS² : 2 HS = 38 : 34.
Ist nun der gefundene Schwefelwasserstoff HS = u, so ist
der Schwefelkohlenstoff welcher ihm entspricht
k = 1,1176 . n.
Ich will hier noch ein Beispiel einer Bestimmung anfügen, welche mit Heidelberger Gas
gemacht wurde. Zwei nacheinander genommene Gasproben ergaben
I.
II.
CO²
7,61
7,52
C²ⁿ H²ⁿ
71,00
70,50
H C²H⁴
793,1
794,0
HS
0,00
0,00
O
–
–
CO
60,01
59,30
Eine an demselben Tage begonnene Leuchtgasanalyse nach der Bunsen'schen Methode ergab folgende Resultate, die in den wesentlichsten
Punkten mit den obenstehenden übereinstimmen:
HS
=
0,00
CO²
=
0,80
O
=
0,00
C²ⁿ H²ⁿ
=
7,02
N
=
12,21
CO
=
– 0,38
H
=
44,53
C²H⁴
=
37,02
––––––
Summa 101,20
Das Auffallendste hierbei ist der durch die kleine negative Zahl angedeutete totale
Mangel an Kohlenoxyd, welcher damals keine Erklärung fand, sowie der auffallend
große Gehalt an Stickstoff, der offenbar auf Undichtheit der Leitung, oder noch
eher, da kein Sauerstoff ihn begleitete, der Retorte und Vorlage schließen läßt.
Vielleicht ließe sich die gewagte Behauptung aufstellen, daß der Sauerstoff der
atmosphärischen Luft das Kohlenoxyd zu Kohlensäure oxydirt habe, wodurch beide
verschwanden, während der Stickstoff noch ihre vorhergehende Anwesenheit
anzeigte.
Bei derartig großem Gehalt an Stickstoff, der übrigens nur äußerst selten gefunden
wird, leidet allerdings die Bestimmung von Wasserstoff und Methylwasserstoff an
Ungenauigkeit, und müßte es daher versucht werden, auf einfache Weise den Stickstoff in eine niedere Oxydationsstufe und dann in
Ammoniak überzuführen, wodurch jener Fehler eliminirt und der Stickstoff leicht
bestimmt werden könnte. Im Allgemeinen jedoch ist das Quantum des jedenfalls nur aus
der Atmosphäre stammenden freien Stickstoffs so klein, daß er als Fehlerquelle
vernachlässigt werden kann.
Pforzheim, den 30. October 1867.
Tafeln