| Titel: | Die Zukunft der Chlorindustrie; von Dr. F. Hurter. |
| Autor: | S. |
| Fundstelle: | Band 249, Jahrgang 1883, S. 126 |
| Download: | XML |
Die Zukunft der Chlorindustrie; von Dr. F. Hurter.
Mit Abbildung auf Tafel 6.
Hurter, über die Zukunft der Chlorindustrie.
Die einzige Hoffnung, daſs der Ammoniak-Sodaprozeſs den
Leblanc-Sodaprozeſs nicht ganz verdrängen kann,
gründet sich darauf, daſs die Welt ebenso wohl Chlor, als Soda gebraucht. Weldon, Solvay und Mond
thun ihr Bestes, um die Chlorindustrie mit dem Ammoniaksodaprozesse zu vereinigen,
oder doch durch ein dem Chlorkalke und Chlorate äquivalentes Mittel die
Chlorproducte zu entwerthen.
Hurter sucht nun in einem eingehenden Vortrage (vgl. Journal of the Society of Chemical Industry, 1883 S.
103) darzuthun, in wie fern die Ammoniaksoda-Industrie der Chlorfabrikation gefährlich
werden kann und in welchem Sinne gegen letztere vorgegangen wird; er erläutert an
der Hand der Thermochemie, in welcher Richtung die jetzt bestehende Chlorindustrie
noch gefördert werden kann.
1) Andere Bleichmittel ah Ersatz für Chlor. Da Chlor aus
den Chlorcalciumlaugen der Ammoniaksoda-Industrie nicht in brauchbarer Form gewonnen
werden kann, so sucht L. Mond ein anderes
Oxydationsmittel, welches auch bleichend und desinficirend wirkt, dafür an die
Stelle zu setzen. Mond hat ein Patent erworben für die
Fabrikation von Calciumsuperoxyd und für dessen Anwendung in der Bleicherei. Da
Calciumsuperoxyd unlöslich ist, wird man wahrscheinlich damit so bleichen müssen,
daſs man es erst in Wasserstoffsuperoxyd umsetzt, was mit einer verdünnten Säure
leicht geschehen kann.
Nach diesem Verfahren [werden in einem Kupolofen getrocknete Stücke eines Gemisches
von Bariumcarbonat, Pech und Sägespänen eingefüllt und auf etwa 1200° erhitzt. Das
Bariumcarbonat setzt sich in Bariumoxyd um und die Kohlenstoff haltigen Producte
brennen weg. Sinkt die Masse allmählich in den unteren Theil des Ofens, so kommt sie
mit einem Luftstrome zusammen, welcher den Baryt auf etwa 500° abkühlt, worauf unter
Absorption von Sauerstoff die Bildung von Bariumsuperoxyd erfolgt. Das kalt
gewordene Bariumsuperoxyd wird mit Kohlensäure und Wasser unter Druck in
Bariumcarbonat und Wasserstoffsuperoxyd umgesetzt; das Bariumcarbonat wird von Neuem
verwendet und das Wasserstoffsuperoxyd mit Kalkmilch in Calciumsuperoxyd
umgesetzt.
Der Prozeſs ist sehr sinnreich und stehen ihm kaum unüberwindliche Schwierigkeiten
entgegen. Das theure Bariumsuperoxyd konnte natürlich nie mit Chlorkalk concurriren;
daſs aber Barium nur als Sauerstoffüberträger benutzt wird, um das Kalksuperoxyd zu
bilden, erleichtert das Aufkommen dieses letzteren neben Chlorkalk. Calciumsuperoxyd
ist ein Hydrat von der Formel CaO2.8H2O; es enthält 7,4 Proc. nutzbaren Sauerstoff, was
32,8 Proc. bleichendem Chlore entspricht. Das Product kann also nur in dem Falle mit
Chlorkalk concurriren, wenn es bedeutend billiger dargestellt werden kann als
dieser. Nach Angaben von G. Lunge soll kaustischer
Baryt in Frankreich erzeugt werden und, wenn einmal Baryt gegeben ist, sollte es
nicht schwer halten, daraus das Superoxyd zu gewinnen.
Die Superoxyde sind alle sehr energische Oxydationsmittel. Nach Thompson sollen bei der Oxydation mit
Wasserstoffsuperoxyd 23 064c für 1 Molekül mehr
frei werden, als wenn mit freiem Sauerstoff oxydirt wurde. Da die frei werdende
Wärme ein Maſs für die Energie der Reaction ist, so sollte man meinen, das neue
Oxydationsmittel hätte jede mögliche Eigenschaft, um in Bleichkraft neben Chlorkalk
vortheilhaft dazustehen. Obschon aber Wasserstoffsuperoxyd ein äuſserst energisches
Oxydationsmittel ist, erscheint es doch zum Bleichen nicht besonders geeignet. Die
Bleichkraft
desselben ist so schwach, daſs man das Material nicht brauchen kann, wenn es auch
bedeutend billiger würde als Chlorkalk.
Wenn man in zwei Lösungen von gleicher oxydirender Kraft, von denen die eine
Wasserstoffsuperoxyd, die andere Chlorkalk enthält, rohe Baumwolle legt, so findet
man, daſs sich die Baumwolle in der Wasserstoffsuperoxydlösung selbst in 48 Stunden
nicht verändert, während Chlorkalk in den ersten 5 Minuten sehr energisch bleicht.
Der Unterschied der beiden Lösungen ist so entschieden und so abweichend von dem,
was sich erwarten lieſs, wenn man die beiden Stoffe als Oxydationsmittel betrachtet,
daſs man unwillkürlich zu dem Schlüsse kommen muſs, nicht der freie Sauerstoff wirke
bleichend auf vegetabilische Fasern, sondern direkt das nutzbare Chlor. Gerhardt schreibt die bleichende Wirkung der
Leichtigkeit zu, mit welcher Chlor an Stelle von Wasserstoff in organische
Verbindungen eintritt. Ein Versuch bestätigt diese Ansicht: Schmilzt man gebleichte
Baumwolle mit Soda, so findet man nachher in der Schmelze Chloride, während
ungebleichte Baumwolle bei der gleichen Behandlung keine Spur Chlor erkennen
läſst.
Wasserstoffsuperoxyd ist die einzige Verbindung, welche billig genug dargestellt
werden könnte, um neben Chlorkalk als Bleichmittel aufzutreten. Die Concurrenz mit
Chlorkalk ist aber der langsamen Wirkung halber unmöglich, selbst wenn es 100 mal
billiger abgesetzt werden könnte als Chlorkalk. Es sind von Zeit zu Zeit auch andere
Bleichmittel vorgeschlagen worden, welche aber sämmtlich Oxydationsmittel sind. Wenn
es also bleichendes Chlor und nicht Sauerstoff ist, welches die bleichende Wirkung
besitzt, so ist die Wahrscheinlichkeit eine geringe, daſs diese Stoffe je Chlorkalk
übertreffen werden.
Eine Preisliste für die verschiedenen Bleichmittel, auf Mengen berechnet, welche
16t nutzbaren Sauerstoff enthalten bezieh.
entsprechen, zeigt, daſs Chlorkalk wenigstens für die nächste Zukunft unübertroffen
bleiben wird:
Chlorkalk
20
Tausend M.
Chlorsaures Kalium
30
„
Uebermangansaures Kalium
51
„
Chromsaures Kalium
109
„
Bariumsuperoxyd
480
„
Wasserstoffsuperoxyd
1490
„
Ferridcyankalium
2630
„
2) Gewinnung von Salzsäure. Aus Chlornatrium kann man
Chlor bis jetzt noch nicht direkt erzeugen. Man stellt immer erst Salzsäure und aus
dieser Chlor dar. Im Leblanc'schen Sodaprozesse wird
das Natrium im Kochsalze erst durch Wasserstoff ersetzt, der durch Schwefelsäure
zugeführt wird und als solcher etwa 2000 M. für 1t
kosten mag. Beim Ammoniaksodaprozesse wird Calcium zur Vertretung des Natriums
benutzt, welches erstere sich auf etwa 15 M. für 1t stellt. Auſser Calcium und Wasserstoff gibt es kaum zwei billigere Elemente,
welche das Natrium leicht vertreten könnten.
Das Chlor im Chlorcalcium ist fast ebenso fest gebunden wie das Chlor im
Chlornatrium. Die Affinität zwischen Calcium und Chlor ist nur etwa 5 Proc. geringer
als diejenige zwischen Natrium und Chlor. In der Salzsäure dagegen ist das Chlor
sehr lose am Wasserstoffe gebunden und kann deshalb verhältniſsmäſsig leicht daraus
frei gemacht werden.
Solvay und Weldon bemühen
sich, die Chlorcalciumlaugen des Ammoniakverfahrens für die Darstellung von Chlor
nutzbar zu machen, mit einem Prozesse, der in Folgendem besteht: Das Calcium soll im
Chlorcalcium durch Wasserstoff ersetzt werden. Chlorcalcium wird, mit Thon gemischt
und in kleine Stücke geformt, bei hoher Temperatur dem Einflüsse von überhitztem
Wasserdampfe ausgesetzt. Es bildet sich dabei sehr verdünnte Salzsäure, aus welcher
mit concentrirter Chlorcalciumlauge der Wasserdampf aufgenommen und die Salzsäure
dann für sich condensirt wird (vgl. Lunge 1882 243 161). Arbeitet man mit 20procentigen
Chlorcalciumlaugen und erhält ein durch Wasserdampf auf 5 Proc. reducirtes
Salzsäuregas, so hat man für je 100t zersetztes
Chlornatrium etwa 1000t Wasser (aus der
Chlorcalciumlauge, welche wieder auf die erste Concentration eingedampft wird) zu
verdampfen. Bedenkt man, daſs für jedes Molekül frei gewordene Salzsäure etwa
26000c zugeführt werden müssen, daſs
Reactionen, welche Wärme absorbiren, äuſserst langsame sind und daſs der ganze
Prozeſs viel Arbeit und Apparate verlangt, so sieht man ein, daſs von dieser Seite
die Leblanc'sche Chlorindustrie nicht so schnell
gefährdet werden kann.
Vorster und Grüneberg empfahlen vor Jahren ein
Verfahren, Chlornatrium und Thon zu erhitzen und daraus Natriumsilicat und Salzsäure
zu gewinnen, muſsten es aber aufgeben, da die Reaction einer auſserordentlich hohen
Temperatur bedarf und weil die Kosten für Ausbesserungen allzu groſs wurden.
Verschiedene Chlorverfahren. Zersetzt man Chlornatrium
nach dem alten Sulfatprozesse mit Schwefelsäure, so kann man die gasförmige oder die
flüssige Salzsäure zur Darstellung von Chlor verwenden, je nachdem man nach Deacon's oder Weldon's
Verfahren arbeitet. Bei Hargreaves' Verfahren kann man
nur die flüssige Säure verwenden, da die gasförmige zu stark mit Stickstoff verdünnt
und zu arm an Sauerstoff ist.
Um die Salzsäure in Chlor umzusetzen, muſs man ein anderes Element mit Wasserstoff
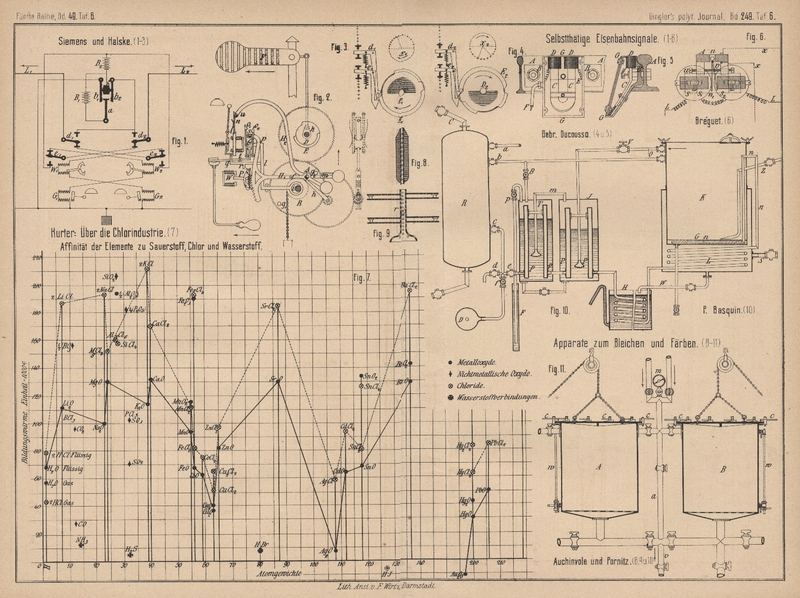
vereinigen und zwar kann dieses nur Sauerstoff sein (vgl. Fig. 7 Taf.
6, woraus zu entnehmen, daſs jede andere Wasserstoffverbindung eine niederere
Bildungswärme hat, Wasser ausgenommen). Die Affinität zwischen Wasserstoff und Chlor
und die zwischen Wasserstoff und Sauerstoff ist so wenig verschieden, daſs der
bloſse Uebergang vom flüssigen in den gasförmigen Zustand die Verhältnisse
ändert.
Die Affinität, in Wärmeeinheiten ausgedrückt, welche während der Vereinigung frei
wurden, ist für:
Flüssig
Salzsäure 2HClWasser H2O
==
7864068360
–––––
Cl2 > 0 Ueberschuſs
10280
Gasförmig
Salzsäure 2HClWasser H2O
==
4400058700
–––––
O > Cl2 Ueberschuſs
14700
Wegen dieser Verschiedenheiten ist eine direkte Zersetzung von flüssiger Salzsäure
durch freien Sauerstoff unmöglich, während diese im Graszustande direkt durch
Sauerstoff zersetzt werden kann, weil im Gaszustande das Wasser, im flüssigen
Zustande die Salzsäure die festere Verbindung ist.
Um aus flüssiger Salzsäure Chlor darstellen zu können, muſs man nicht allein
Sauerstoff zuführen, sondern auch eine gewisse Menge chemische Energie: man muſs
nascirenden Sauerstoff haben, welcher unter Wärmeentwickelung frei wird. Solcher ist
nur von einem Oxyde zu erhalten, welches unter Bildung von Chlorid sowohl
Sauerstoff, als auch die nöthige Wärme zur Abtrennung des Chlores von
Chlorwasserstoff abzugeben im Stande ist. Da das Oxyd mehr Sauerstoff enthalten
muſs, als dem Chlore entspricht, welches nachher Chlorid bildet, so sind wir auf
Superoxyde angewiesen und unter den Superoxyden speciell auf Mangan, da kein anderes
Element sich aus dem Chloride so leicht als Superoxyd regeneriren läſst und kein
anderes sich im Preise so günstig stellt. Ein Blick auf die Figur 7 Taf.
6 wird dies erläutern: Es befindet sich dort kein anderes technisch brauchbares
Element, von welchem 2 Oxyde und nur 1 Chlorid bekannt sind, mit Ausnahme von Blei
und Barium. Bei Barium würde es sehr schwer halten, das Chlorid in das Superoxyd
umzusetzen, wegen des groſsen Unterschiedes in den Bildungswärmen der beiden
Verbindungen. Blei kommt auſser Frage, einerseits des Preises, andererseits seines
hohen Aequivalentgewichtes halber. Mangan ist in seiner Stellung einzig; das Chlorid
desselben steht zwischen den beiden Oxyden, so daſs es verhältniſsmäſsig leicht sein
muſs, das Chlorid in Superoxyd umzusetzen.
Was nun Weldons Prozeſs Nr. 1 (vgl. 1882 245 * 24. 246 421), wie er
jetzt allgemein im Gebrauch ist, betrifft, so ist derselbe nur dann zu übertreffen,
wenn ein Superoxyd gefunden werden kann, welches billiger ist als die Kosten der
Regeneration des Mangansuperoxydes, was nach dem oben Gesagten sehr schwer halten
wird, oder wenn die Regeneration selbst viel billiger ausgeführt werden kann. Der
groſse Nachtheil von Weldon's Prozeſs Nr. 1 ist, daſs
man durch ihn theoretisch nur ⅓ der Salzsäure als Chlor gewinnt. Weldon's neuer Prozeſs Nr. 2 soll diesen Fehler
vermeiden und eine vollständige Gewinnung des Chlores in der Salzsäure gestatten.
Magnesiummanganit, durch Verfahren Nr. 1 gewonnen, wird in den Chlortrögen mit Salzsäure zersetzt.
Man erhält dabei ¼ der Salzsäure als freies Chlor neben einer Lösung von Chlormangan
und Chlormagnesium. Die Lösung wird zur Syrupdicke eingedampft und mit einer
gewissen Menge trockenen Manganits gemischt, in Stücke geformt, in einen dem Hargreaves'schen ähnlichen Apparate beschickt und einem
heiſsen Luftstrome ausgesetzt, wobei 90 Procent der vorhandenen Chloride unter
Bildung von Magnesiummanganit freies Chlor abspalten.
Wenn nun nach Hurter überhaupt in Chlortrögen gearbeitet
werden muſs, so kann der Chlorkalk nicht billiger werden, da man im besten Falle den
Kalk spart, der jetzt zum Oxydiren nöthig ist, etwa 500k für 1t Chlorkalk. Die Kosten für Luft
würden durch eine Menge kleiner Schwierigkeiten reichlich aufgewogen. – Was hat man
in diesem neuen Prozesse alles zu thun, um die 500k Kalk zu sparen? Die ganze Chlorbrühe muſs zur Trockene eingedampft
werden, etwa 3t Wasser für 1t Chlorkalk. Es müssen
für 1t Chlorkalk 5 bis 7t Chlorid und Oxyd gemischt und in Stücke geformt
werden. Von dem trockenen Manganit müssen für 1t
Chlorkalk mindestens 2t in die Zersetzungsapparate
beschickt werden, die 10 fache Menge Material wie beim jetzigen Deacon-Prozesse. Es ist kaum vorauszusehen, wie viel
man bei den umständlichen Apparaten durch Undichtheiten zu leiden hätte, da die Luft
durch 8 Cylinder, durch Condensationsthürme und Chlorkalkkammern gesaugt werden
muſs. Dann würde man nur sehr schwaches Chlorgas erhalten, welches der Theorie nach
schwächer ist als im Deacon-Prozesse. Wer nun weiſs,
daſs bei letzterem Verfahren Alles von einer guten
Zersetzung, von an Chlor reichen Gasen abhängt und daſs sich die Kosten für
Arbeitslohn und Apparate mit den Schwierigkeiten mehren, die sich bei der
praktischen Durchführung zeigen, der wird sich vorstellen können, was ein so
schwaches Chlorgas für die Fabrikation von starkem Chlorkalk bedeutet. Gewiſs würde
der gesammte Chlorkalk vom Weldon-Prozesse Nr. 2 nicht
billiger als das der Menge nach kleinere Ergebniſs von Prozeſs Nr. 1.
Sehen wir, was die Thermochemie uns von dem Prozesse verspricht. Die Umsetzung von
Manganchlorid in Superoxyd wird eine doppelte sein, deren Wärmeverhältnisse
ungünstige sind. Bei der Umsetzung von MnCl2 in MnO
wird weit mehr Wärme absorbirt, als bei der Umsetzung von MnO in MnO2 frei wird, und zwar so viel mehr, daſs die
Temperatur des Luftstromes in den Apparaten 300 bis 400° niederer würde. Einige
Versuche zeigen, daſs das Magnesium völlig passiv bei der Reaction bleibt, daſs die
Oxydation nicht weiter als Mn2O3 geht und daſs die Umsetzung von Chlorid in Oxyd im
besten Falle auf 90 Proc. kommt. Dann entsteht nicht Chlor allein, sondern ziemlich
viel Salzsäure daneben, was sich jedoch im Groſsbetriebe ändern möchte.
Vergleichen wir den Deacon-Prozeſs mit dem neuen Weldon'schen Verfahren Nr. 2; er ist der einzige,
welcher bis jetzt im Stande ist, Salzsäuregas durch eine einfache Reaction in Chlor
umzusetzen. Bei der Reaction: 2HCl + O = H2O + Cl2 wird Wärme frei. Sie wird durch Catalyte
beschleunigt, am günstigsten durch Kupferchlorid wegen dessen Dissociationsvermögen
bei hoher Temperatur, wobei dann Wärme in chemische Energie umgesetzt wird.
Kupferchlorid zersetzt sich bei etwa 400° in Kupferchlorür und Chlor unter
Absorption von Wärme:
2CuCl2
=
Cu2C12
+ C12
. . . . . . (1)
103260c
=
65760c
+ 37500c (absorbirt).
Kupferchlorür absorbirt Sauerstoff und wird, zu Kupferoxyd
umgesetzt unter Freiwerden von Chlor- das Kupferoxyd setzt sich mit Salzsäure in
Kupferchlorid und Wasser um:
Cu2Cl2
+ 2O
= 2CuO + Cl2
. . . . . . (2)
65760c
= 74320c – 8560c (frei geworden).
2CuO + 4HCl
= 2CuCl2 + H2O
. . . . . . (3)
74320c + 88000c
= 103260c +114000c – 54940c (frei geworden).
In diesen beiden Reactionen (2) und (3), welche in gleichem
Maſse vor sich gehen, wird Wärme frei und zwar mehr, als in der ersten bei der
Dissociation von Kupferchlorid gebunden wird. Es gibt kein anderes Element, welches
2 Oxyde und 2 Chloride bildet, welche so leicht in einander umgesetzt werden können;
es gibt auch keinen billigeren und wirksameren Catalyt wie Kupfer und darum wird der
Deacon-Prozeſs der einzige bleiben, welcher
Salzsäuregas in Chlor umzusetzen im Stande ist.
Wir sind bei folgenden Schlüssen angekommen: 1) Kein anderes Chlorid eignet sich so
vortheilhaft zur Fabrikation von Chlor wie Chlorwasserstoff. 2) Soll
Chlorwasserstoff im flüssigen Zustande zersetzt werden, so kann dies nur mit
Mangandioxyd geschehen, da kein anderes Superoxyd sich aus dem Chloride so leicht
regeneriren läſst. 3) Soll Chlorwasserstoff im Graszustande zersetzt werden, so
bedarf man eines Catalyten. Wenn ein solcher vortheilhafter als Kupfer überhaupt
gefunden wird, so bleiben die Apparate doch wesentlich dieselben.
Die Veränderungen, welche nach dem Vorangegangenen der Chlorindustrie bevorstehen,
sind die, daſs der Deacon'sche Prozeſs wesentlich
derselbe bleiben und daſs im Weldon'schen Prozesse,
eine günstigere Regeneration des Superoxydes gefunden werden muſs, wobei dann die
Salzsäure besser ausgenutzt wird. Beide Verfahren werden aber nach wie vor neben
einander bestehen.
Erklärung des Diagrammes Fig. 7
Taf. 6: Die der Groſsindustrie zugänglichen Elemente sind so
zusammengestellt, daſs die Verbindungen derselben über deren Atomgewicht stehen und
zwar so hoch auf der Abscisse, als den Bildungswärmen der betreffenden Verbindungen
entspricht, d.h. der Wärmemenge in Wärmeeinheiten, welche bei der Verbindung der einzelnen
Elemente frei wird. Wasserstoff steht z.B. auf Abscisse 1. Bei der Vereinigung von
Wasserstoff und Chlor werden 44000c frei; somit
steht Salzsäure auf Ordinate 44.
Es ist immer leicht, eine Reaction auszuführen, bei welcher Wärme frei wird, während
es umgekehrt verhältniſsmäſsig schwer, oft unmöglich ist, Wärme in chemische Energie
umzusetzen; es wird also leicht sein, eine Verbindung mit kleiner Bildungswärme in
eine andere mit gröſserer Bildungswärme umzusetzen, während das Umgekehrte in einer
einfachen Reaction immer schwer, oft unausführbar ist. So läſst sich Na2O in NaCl leicht umsetzen, ebenso K2O in KCl u.s.f., während das Umgekehrte durch
einfache Reactionen kaum möglich ist. Die Reactionen, bei denen Wärme gebunden wird,
sind meist um so schwieriger, je mehr Wärme absorbirt wird. Die Schwierigkeiten
bestehen natürlich nicht allein darin, durch Brennmaterial die nöthige Wärme
zuzuführen, sondern hauptsächlich in dem Umstände, daſs solche Reactionen überhaupt
schwer durch einfache Reactionen auszuführen sind und nur durch kostbare, indirekte
Prozesse umgangen werden können.
Bei dem Beispiele Kupfer sehen wir, daſs es leicht sein muſs, irgend eines der
Chloride oder Oxyde in ein beliebiges anderes umzusetzen, da die Bildungswärmen
aller 4 Verbindungen sehr nahe beisammen liegen (wie bei keinem anderen Elemente).
Bei Mangan sollte es, nach der Bildungswärme zu schlieſsen, sehr leicht sein, das
Chlorid in Superoxyd umzusetzen. In Chlorwasserstoff muſs der Wasserstoff nach dem
Diagramme sehr reactionsfähig sein, weil alle anderen Chlorverbindungen viel höher
stehen. Damit steht natürlich im Zusammenhange, daſs die Chloride sehr feste
beständige Verbindungen sein müssen.
S.
Tafeln