| Titel: | Die Raoult'sche Methode der Molekulargewichtsbestimmung; von Constantin Klinge. |
| Autor: | Constantin Klinge |
| Fundstelle: | Band 273, Jahrgang 1889, S. 272 |
| Download: | XML |
Die Raoult'sche Methode der
Molekulargewichtsbestimmung; von Constantin Klinge.
(Schluſs der Abhandlung S. 217 d. Bd.)
Mit Abbildungen auf Tafel
11.
Die Raoult'sche Methode der
Molekulargewichtsbestimmung.
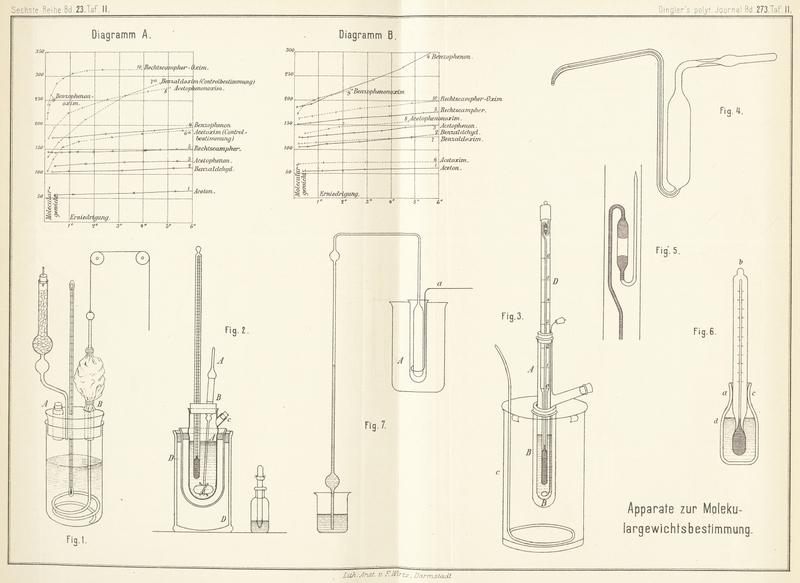
Dem Thermometer eigenthümlich ist das besonders (Fig. 5) abgebildete, an
die Kapillare angeschmolzene, nach abwärts gebogene Quecksilberreservegefäſs.
Der Quecksilbervorrath in dem Thermometer ist so groſs, daſs davon beim Eintauchen in
Eis die Kapillare bis zum oberen Theile der Scala gefüllt wird. Gesetzt nun, man
wolle Gefrierpunktsbestimmungen in Eisessig ausführen, so muſs so viel Quecksilber
aus der Kapillare entfernt werden, daſs bei 16° und darunter Ablesungen gemacht
werden können. Zu dem Behufe taucht man das Instrument in Wasser von 17° bis 18° und
schleudert darauf das aus der Kapillare ausgetretene Quecksilber durch einen kurzen
Stoſs nach abwärts auf den Boden des Reservegefäſses. Beim Abkühlen wird nun die
Temperatur auf der Scala
ablesbar werden, wenn nickt, wird das Ausschleudern wiederholt. War zu viel
Quecksilber entfernt, so läſst sich der Schaden schnell wieder gut machen, indem man
durch leichtes seitliches Anklopfen an das Reservegefäſs Quecksilbertröpfchen in die
Nähe der Kapillare verspritzt und diese mit dem durch Wärme überzutreibenden
Quecksilberfaden zusammenflieſsen läſst, bis derselbe beim Abkühlen die gewünschte
Länge zeigt. Die Vereinigung des gesammten Quecksilbervorrathes geschieht leicht,
indem man das Thermometer umkehrt, etwas Quecksilber in das Reservegefäſs treten
läſst und nun leicht nach unten aufstöſst. Ein Zurückfallen des abgetrennten
Quecksilbers ist bei der getroffenen Anordnung natürlich ausgeschlossen, aber auch
ein Loslösen des Quecksilbers von der Kapillare, wenn es theilweise in das
Reservegefäſs übergetreten ist, findet beim Arbeiten niemals statt; man kann also
ohne Entfernung des Thermometers schwerlösliche Körper sonder Bedenken durch
Erwärmen und Rühren in Lösung bringen. Bei wagerechter Lage des Thermometers haftet
natürlich das Quecksilber weniger fest.
Die Scala ist in 1/100 genaue Celsiusgrade getheilt, aber mit willkürlicher Bezifferung
versehen und umfaſst etwa sechs Grade. Um die Kapillare, den theuren Theil des
Instrumentes, für die Ablesung völlig auszunutzen, ist zwischen dieselbe und das
Quecksilbergefäſs ein längerer Glasstiel eingeschaltet. Das Quecksilbergefäſs ist
ziemlich groſs und stark im Glase ausgeführt worden, um einen leichten und sicheren
Gang des Quecksilberfadens zu erreichen.
Nach diesem Verfahren sind bereits Hunderte von Versuchen ausgeführt worden, und
gehören die ResultateBeckmann, Zeitschr. für phys. Chem., II,
717. wohl zu den genauesten, welche bis jetzt mit Hilfe der Raoult'schen Methode erzielt worden sind.
Ein äuſserst einfaches Verfahren hat ferner EykmannZeitschr. für phys. Chem., II,
964. in Vorschlag gebracht. Der Apparat (Fig. 6) besteht aus einem
kleinen Kölbchen von etwa 10cc Inhalt, worin ein
kleines Thermometer, über etwa 5° in Zehntel getheilt, eingeschliffen ist. Nachdem
vorher mit dem Apparate der Gefrierpunkt des Lösungsmittels festgestellt worden ist,
wird in das Kölbchen etwa 0,002 Grammmolekül (bis auf mg genau gewogen) der Substanz
hineingebracht, ferner etwa bis zur Höhe d
(entsprechend 6 bis 8g) Lösungsmittel eingegossen,
das Thermometer eingesetzt und die Gesammtmenge des Lösungsmittels + Substanz durch
Wägung des ganzen Apparates, dessen Tara bekannt ist, bestimmt. Nachdem die Substanz
sich gelöst hat, wird der Inhalt zur partiellen Krystallisation gebracht und sodann
durch Erwärmen wieder so weit aufgethaut, bis nur noch wenige Krystallnadeln in der
Flüssigkeit schweben, wobei man Sorge trägt, daſs die Temperatur nicht erheblich
über den Gefrierpunkt des Gemisches steigt. Durch Hin- und Herschwenken des
Apparates, welchen man bequem zwischen drei Fingern (bei a,
b, c) faſst, wird der Inhalt sanft geschüttelt. Die Temperatur geht
zunächst einige Zehntel unter den wahren Gefrierpunkt herab, um sodann unter
theilweisem Ausfrieren des Lösungsmittels schnell zu steigen und nachher wieder zu
sinken., wobei das genügend lange constant bleibende Maximum zu notiren ist (1/100 Grade sind
zu schätzen, wo nöthig unter Anwendung einer Lupe). Durch Wiederaufbauen u.s.w. kann
die Bestimmung öfters wiederholt werden, was nur wenige Minuten in Anspruch nimmt.
Bei richtigem Handhaben bekommt man Resultate, die höchstens um ein paar 1/100-Grade
differiren. Erfolgt die anfängliche Krystallisation des Lösungsmittels nicht ohne
Weiteres von selbst, so wird dieselbe durch kurzes Eintauchen in eine kleine Menge
eines Kältegemisches hervorgerufen. Die Luft, worin das Schütteln vorgenommen werden
soll, kann, wo nöthig, mittels eines mit kaltem Wasser beschickten
Kalorimetergefäſses abgekühlt werden, oder auch der ganze Apparat in eine weite
Reagensröhre hineingesteckt und mittels Glaswollepfropfen oben und unten
festgehalten, zu gleichem Zwecke in kaltes Wasser getaucht werden. Als Vorzüge des
Verfahrens mögen hervorgehoben sein, daſs das Einwerfen von Krystallen und das
Oeffnen des Apparates während der Operation, sowie die Rührvorrichtung umgangen
werden, so daſs die Bestimmung mit derselben Menge Substanz ohne irgend welchen
schädlichen Einfluſs öfters wiederholt werden kann.
Die molekularen Depressionen von PhenolZeitschr. für phys. Chem., II, 965.
und NaphtalinZeitschr. für phys. Chem., III 113.
sind, unter Anwendung dieses Verfahrens, von Eykmann
festgestellt worden.
Der Vollständigkeit halber sei noch ein Apparat erwähnt, welchen R. Fabinyi zur Bestimmung der molekularen Depression
des Naphtalins in Benutzung gezogen hat. Da derselbe jedoch schwerlich allgemeine
praktische Anwendung finden dürfte, so sei bezüglich näherer Angaben auf die
Originalarbeit (Zeitschr. für phys. Chem., III, 38)
verwiesen.
Zum Schlusse sei noch ein Apparat von CiamicianBerichte, XXII, 31.
beschrieben, welcher gestattet, das Raoult'sche Gesetz
einem gröſseren Publikum zu demonstriren, und daher zu Vorlesungszwecken
empfehlenswerth ist.
Der Apparat (Fig.
7), der im Wesentlichen aus einem Luftthermometer besteht, ist schon aus
der Zeichnung leicht verständlich. Ein gröſseres Reagensglas von ungefähr 16cm Höhe und 2cm,5 Durchmesser, zur Aufnahme der Lösungen bestimmt, befindet sich in einer
Kältemischung, die, weil die Versuche mit wässerigen Lösungen ausgeführt wurden, aus
Schnee und etwas Kochsalz bestand. In die zu untersuchende Lösung taucht, in der aus
der Zeichnung ersichtlichen Weise, ein Luftthermometer, dessen cylindrisches Gefäſs
eine Länge von 12cm und einen Durchmesser von 1cm,5 besitzt; letzteres ist an ein enges, zweimal rechtwinklig
gebogenes Glasrohr von etwa 1mm,5 Lichtweite,
welches in ein Becherglas mit gefärbtem Wasser taucht, angeschmolzen. Das etwa 70cm lange Rohr ist an zwei Stellen kugelförmig
angeblasen, die obere Kugel sichert vor einem Zurücksteigen der Flüssigkeit bei zu
starker Abkühlung, die untere verhindert das Auftreten der Luft bei zu starker
Erwärmung.
Man beginnt die Versuche mit der Bestimmung des Gefrierpunktes des Wassers; beim
Eintauchen des Reagensrohres A in die Kältemischung und
lebhaftem Rühren mit dem Rührer a steigt das gefärbte
Wasser sehr rasch in dem engen Rohre, und da in der Regel Ueberkaltung eintritt,
sinkt bei der beginnenden Eisbildung die Säule plötzlich auf eine bestimmte Höhe,
auf welcher sie dann unverändert stehen bleibt. Auf diese Weise wird die Erscheinung
sehr schön auch von der Ferne sichtbar, und man liest den Stand des gefärbten
Flüssigkeitsfadens entweder auf einer papierenen Scala ab oder markirt ihn durch
einen Gummiring.
Macht man jetzt den Versuch mit verschiedenen Lösungen, die in dem gleichen Volumen
Wasser (etwa 100cc) molekulare Mengen
verschiedener organischer Verbindungen enthalten, so stellt sich bei den einzelnen
Bestimmungen die Flüssigkeitssäule ziemlich genau auf derselben Höhe ein, und zwar
natürlich höher als bei Anwendung von reinem Wasser. Die Differenz betrug bei den
Versuchen von Ciamician mit Lösungen von je 34g,2 Rohrzucker, 18g,2 Mannit, 5g,8 Aceton, 6g,0 Eisessig gelöst in 100cc Wasser mehrere Centimeter und war daher auch
von der Ferne recht gut bemerkbar. Die Lösungen können während der Vorlesungen
bereitet werden, und es läſst sich somit auf diese Weise recht schön zeigen, daſs
isotonische Lösungen dieselbe Gefrierpunktserniedrigung besitzen.
Lösungsmittel.
Als lösende Mittel benutzte Raoult im Laufe seiner
Untersuchungen Wasser, Benzol, Nitrobenzol, Aethylenbromid, Ameisensäure,
Essigsäure, Thymol und Naphtalin.
In neuerer Zeit sind folgende Lösungsmittel in Anwendung gebracht worden.
Mol./Depression T
Wasser
19
Benzol
49
Eisessig
39
Phenol
76
Naphtalin
70 (80).
Da die Zahl der organischen Verbindungen, welche hinreichend in Wasser löslich sind,
eine relativ geringe ist, so kann das Wasser als Lösungsmittel keine ausgedehnte
Anwendung finden, und würde dasselbe vornehmlich bei der Bestimmung des
Molekulargewichtes von Alkoholen, Phenolen und Säuren zu gebrauchen sein.Auwers, Berichte, XXI, 705.
Raoult schreibt vor, bei Anwendung von Wasser die Concentration so zu
wählen, daſs die Depression etwa 1° beträgt. Da nun die molekulare Depression des
Wassers 19 beträgt, so ergibt sich durch einfache Rechnung, daſs, um diesen
Vorschriften Raoult's zu genügen, ziemlich groſse
Substanzmengen erforderlich sind, namentlich wenn das Molekulargewicht der zu
untersuchenden Substanz ein sehr hohes ist. Dagegen empfiehlt sich das Wasser durch
seine stark dissociirenden Eigenschaften.Beckmann, Zeüschr. für phys. Chem., II,
742. Bedeutend günstiger liegen die Verhältnisse beim Benzol, welches
in seiner Handhabung das bequemste und die relativ gröſsten Erniedrigungen liefernde
Lösungsmittel ist. Bei seiner geringen dissociirenden Kraft ist bisweilen starke
Verdünnung erforderlich, um zu normalen Werthen zu gelangen. Alkohole, Phenole und
Säuren rufen in Benzol anormale Depressionen hervor. Für diese Körperklassen gibt
Raoult die molekulare Depression des Benzols T = 25 an.
Die allgemeinste Anwendung hat Eisessig gefunden. Auch dieser wirkt stark
dissociirend und liefert meist normale, von der Concentration unabhängige Werthe.
Ein günstiger Umstand liegt ferner darin, daſs man in Folge der hohen
Erstarrungstemperatur des Eisessigs mit ihm bei Temperaturen arbeiten kann, welche
von der mittleren Zimmertemperatur wenig oder gar nicht abweichen. Hierzu kommt,
daſs es im Allgemeinen nicht nöthig ist, den Eisessig für diese Bestimmungen absolut
wasserfrei anzuwenden. AuwersBerichte, XXI, 708.
empfiehlt daher, wo es nur irgend angängig ist, in erster Linie Eisessig als
Lösungsmittel zu benutzen.
Phenol, das neben seiner Billigkeit und leicht zu habender Reinheit eine groſse
Lösungsfähigkeit für die meisten Körper besitzt, ist von EykmannZeitschr. für phys. Chem., II,
964. mit groſsem Erfolge als Lösungsmittel angewandt
worden.
Für die molekulare Depression des Naphtalins sind zwei verschiedene Werthe
aufgestellt worden, und zwar T = 70. (Eykmann) und T = 80 (Fabinyi), doch dürfte wohl der kleinere Werth als
richtiger angenommen werden, da derselbe mit dem aus der van
t'Hoff'schen Formel berechneten Werthe übereinstimmt.
Es ist schon im theoretischen Theile darauf hingedeutet worden, welche wichtige Rolle
die Concentration des Lösungsmittels bezüglich der Schärfe der Resultate spielt. –
Um sich daher vor Täuschungen zu sichern, erscheint es immer gerathen, sich durch
den Versuch ein Urtheil über die Abhängigkeit der Werthe von der Concentration zu
bilden. Man führt eine Versuchsreihe aus, welche sich über Depressionen von etwa 0,2
bis 2 oder mehr Graden erstreckt. Ob gröſsere Abweichungen der niedrigsten Werthe
auf Versuchsfehlern beruhen, wird durch Betrachtung der folgenden Werthe sofort
ersichtlich. Je höher die Gehalte sind, um so leichter fallen durch theilweises Ausfrieren des
Lösungsmittels die Erniedrigungen zu groſs aus.Beckmann, Zeitschr. für phys. Chem., II,
743.
––––––––––
Die Resultate, welche bis jetzt durch die Methode erzielt worden sind, ergeben, daſs
dieselbe nicht dazu dienen kann, etwa zwischen zwei nahe bei einander liegenden
Formeln von wenig verschiedener procentischer Zusammensetzung eine Entscheidung zu
treffen, wie dies häufig durch eine Dampfdichtebestimmung möglich ist. Dagegen wird
die Raoult'sche Methode in einer groſsen Anzahl von
Fällen, in denen eine Dampfdichtebestimmung unmöglich ist, als einzig überbleibendes
Mittel zur Bestimmung der Molekulargröſse treffliche Dienste leisten, namentlich
wenn es sich darum handelt, zwischen irgend einer Formel und einem Multiplum oder
Submultiplum derselben zu entscheiden.Auwers, Berichte, XXI, 719.
Die Bedeutung der Methode wird am besten durch die Worte Victor Meyer'sBerichte, XXI, 539.
:
„Die Raoult'sche Methode der
Molekulargewichtsbestimmung ist ohne Zweifel die bedeutungsvollste Bereicherung,
welche der Vorrath an physikalischen Hilfsmitteln, über den die chemische
Forschung verfügt, seit der Entdeckung der Dulong-Petit'schen Methode der Atomgewichtsbestimmung erfahren
hat“, charakterisirt.
Tafeln